
2. 短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述中不正确的是
A. WX2分子中所有原子最外层都为8电子结构
B. WX2、ZX2中的化学键类型和晶体类型都相同
C. WX2是以极性键结合成的非极性分子
D.原子半径大小顺序为:X<W<Y<Z
1.右图为周期表中短周期的一部分,若X原子最外层电子数比次外层电子数少3,则下列 说法正确的是
A.X的氢化物比R的氢化物稳定
B.原子半径大小顺序是Z>Y>X>R
C.Z的单质能与Y的某些化合物发生置换反应
D.X、Z可形成化合物XZ5,分子中各原子均满足最外层8电子结构
26.(8分) 大连盛产品质优良的甜樱桃。甜樱桃中含有一种羟基酸(用A表示),A的碳链结构无支链,化学式为C4H6O5;1.34 g A与足量的碳酸氢钠溶液反应,生成标准状况下的气体0.448 L。A在一定条件下可发生如下转化:
A催化剂加热BCDE
其中,B、C、D、E分别代表一种直链有机物,它们的碳原子数相等。E的化学式为C4H6O6(转化过程中生成的其它产物略去)。
已知:
-CHO+-╵╷-COOR-╵╷-COOR+Zn(OH)X (X代表卤原子,R代表烃基)
A的合成方法如下:
①F+-COOCH2CH3G+ Zn(OH)Br
②G+2H2OA+2M
其中,F、G、M分别代表一种有机物。
请回答下列问题:
(1)A的结构简式是_________。
(2)C生成D的化学方程式是 。
(3)A与乙醇之间发生分子间脱水反应,可能生成的有机物共有 种。
(4)F的结构简式是 。
(5)写出G与水反应生成A和M的化学方程式: 。
25.(9分)向一定压的仪器中充入4LN2和H2的混合气体,反应后恢复到原温度,体积变为3.4L,容器内气体对相同条件下H2的相对密度为5。
⑴反应达到平衡时V(NH3)= L,反应前V(N2):V(H2)= ,
N2的转化率为 ,合成氨反应的平衡常数表达式为 。
⑵向平衡后的容器中再充入0.2molNH3,再达到平衡,测得吸收了6.44kJ的热量。
① 从开始到重新平衡,混合气体对H2的相对密度变化为
A.先增大后变小 B.先减小后增大 C.一直减小 D.一直不变
②生成1mol氨气能够放出热量:
24.(6分) 下图表示从固体混合物中分离X的2种方案,请回答有关问题。
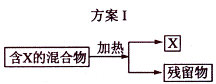
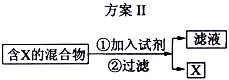


(1)选用方案I时,X应该具有的性质是 ,残留物应该具有的性质是 ;
 (2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是
。
(2)选用方案Ⅱ从某金属粉末(含有Au、Ag和Cu)中分离Au,加入的试剂是
。
 (3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形
(3)为提纯某Fe2O3样品(主要杂质有SiO2、A12O3),参照方案I和Ⅱ,请设计一种以框图形
式表示的实验方案(注明物质和操作)。
23.(13分)A、B、C、D、E五种元素均是短周期的主族元素,原子序数依次增大。B、E原子的最外层电子数均为其电子层数的两倍,D、E元素原子的最外层电子数相等。X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成。元素B形成的单质M与甲、乙均能反应(相对分子质量甲<乙)。转化关系如图(反应条件略去)。请回答下列问题:
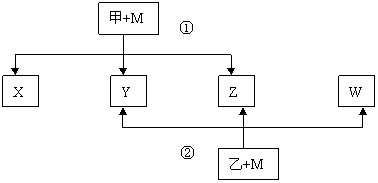
(1)X、Y、Z、W属于同一类物质,这类化合物可称为 ;X、Y、W都能与Z反应,则Z为 (写化学式)。
(2)写出M与甲的浓溶液、M与乙的浓溶液加热时反应的化学方程式:
① ;
② 。
(3)化合物BE2与化合物Y结构相似,则BE2的电子式为 。
(4)上述六种化合物中 是空气质量与预报必须分析测定的物质,他们的危害是 (回答两点即可)。
(5)将X、W与D按1:1:n通入Z中,充分反应后无气体剩余或生成,则n= ;写出 反应的化学方程式 。
22.(9分)已知由短周期元素组成的A、B、C、D、E五种化合物,它们所含原子数目依次为2、3、4、5、6,其中A、B、C、E含有18个电子,D含有10个电子。请回答:
(1)A的化学式是: , 用电子式表示B的形成过程 。
(2)若C为第一和第三周期元素组成的化合物,C在空气中能够自燃生成两种常见的氧化物,化学方程式是 。
(3)若C为第一和第二周期元素组成的化合物,在C的溶液中加入少量二氧化锰,有无色气体生成,则C分子中化学键的类型 和 。
(4)由第二周期元素形成的氢化物E和C都含有18电子, E是一种6原子分子,可做火箭发动机的燃料,C是一种常见强氧化剂。已知16g液态E与液态C充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ的热量。回答下列两个问题:
①请写出E的结构式
②写出E与C反应的热化学方程式:
21.(3分)将某物质通入石蕊溶液中发生的颜色变化为
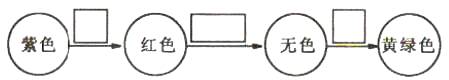
方框内导致该阶段颜色变化的粒子符号依次为 、 、 。
20.有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中剩余Fe2+的物质的量之比为(还原性I->Fe2+>Br->Cl-)
A.7:1 B.7:2 C.7:3 D.7:4
19.某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种。①在该溶液中加入足量的氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色溶液中加入氯化钡溶液时无沉淀产生;③橙黄色溶液不能使淀粉溶液变蓝。根据上述实验事实推断在该溶液中肯定存在的离子组是
A.Na+、Br-、CO32- B.Na+、I-、SO32-
C.Fe2+、I-、SO32- D.Fe2+、CO32-、Br-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com