
39. (化学-有机化学基础)(15分)农村中秸秆的综合利用不仅可以提高经济效益,为农民创收,而且还能防止环境污染。现按下列方式处理:
(化学-有机化学基础)(15分)农村中秸秆的综合利用不仅可以提高经济效益,为农民创收,而且还能防止环境污染。现按下列方式处理:
已知G是有香味的液体,请回答:
(1)F→G的化学方程式:
_______________________________________
E→F的化学方程式:
________________________________________
(2)已知C中含有碳、氢、氧,质量分数分别为40.0%、6.67%、53.5%,其碳原子为B的一半,则C的分子式_____________。
(3)与G的分子式相同,其中含有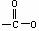 结构的链状同分异构体最多有____________种(不包括G),写出属于不同于G种类的两种同分异构体的结构简式:_________________
结构的链状同分异构体最多有____________种(不包括G),写出属于不同于G种类的两种同分异构体的结构简式:_________________
38.(化学-物质结构与性质)(15分)
Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元素 |
Mn |
Fe |
|
|
电离能( kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
(1)Mn元素价电子的电子排布式为___________________________________________,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。对此,你的解释是:_________________________________________________________________
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①与Fe原子或离子形成配合物的分子或离子应具备的结构特征是
____________________________________________________________________________
②六氯和亚铁离子(Fe(CN)64-)中的配体CN-中C原子的杂化轨道类型是_____________,写出一种与CN-互为等电子体的单质分子的路易斯结构式__________________________。
(3)三氯化铁常温下为固体,熔点:282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为:_______________

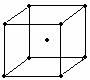 (4)金属铁的晶体在不同的温度下有两种
(4)金属铁的晶体在不同的温度下有两种
堆积方式,晶体分别如右图所示。面
心立方晶胞和体心立方晶胞中实际含
有的Fe原子个数之比为:____________
体心立方 面心立方
37.(化学-化学与技术)(15分)
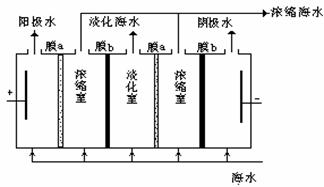 我国有较长的海岸线,浩瀚的海洋
我国有较长的海岸线,浩瀚的海洋
是一个巨大的物质资源和能量宝库。
目前,世界各国都在研究如何充分
利用海洋资源。
(1)如右图,在电场中利用膜技术
(阳离子交换膜只允许阳离子通过,
阴离子交换膜只允许阴离子通过)
淡化海水,该方法称为电渗析法。
①图中膜a应选择_____________膜;
②电渗析法还可以用来处理电镀废液,写出用该方法处理含硫酸铜废液时(使用惰性电极)所发生的电极反应:阴极____________________________________
阳极____________________________________
(2)海水中的溴的储量丰富,约占地球溴总储量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg·L-1。其工业提取法有:
(I)空气吹出纯碱吸入法。该法是将氯气通入到含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到单质溴。该方法涉及的反应有:
①_____________________________________(写出化学反应的离子方程式)
②3Br2+3CO32-=BrO3-+5Br-+3CO2↑
③BrO3-+5Br-+6H+=3Br2+3H2O
其中反应中③的氧化剂是_________________,还原剂是_____________________。
(II)溶剂萃取法。该法是利用单质溴在水中和萃取剂中溶解度不同的原理来进行的 。实验室中萃取用到的主要玻璃仪器名称是_____________。下列可以用于从海水中萃取溴的试剂是__________(填编号)。①乙醇 ②四氯化碳 ③硝酸。
(3)海水中的氘(含HDO 0.03‰)发生聚变的能量,足以保证人类上亿年的能源消费,工业上可采用“硫化氢-水双温交换法”富集HDO。其原理是利用H2S、HDS、H2O和HDO四种物质,在25℃和100℃两种不同温度下发生的两个不同反应得到较高浓度的HDO。
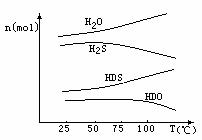 右图为“硫化氢-水双温交换法”所发生的两个
右图为“硫化氢-水双温交换法”所发生的两个
反应中涉及的四种物质在反应体系中的物质的量随温
度的变化曲线。写出100℃时所发生的反应的化学方
程式__________________________________________;
工业上富集HDO的生产过程中,可以循环利用的一种
物质是____________________。
27.(15分)
过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。其中一种方案就是将CO2转化为可再生燃料甲醇(CH3OH)。其化学方程式为:
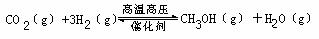
请填空:
(1)写出上述反应的平衡常数表达式:
(2)在容积为2L的密闭容器中,用一定量的二氧化碳和一定量氢气在一定条件下合成甲醇,实验结果如下图所示。下列说法正确的是( )(填序号)
A.在300℃ ,从反应开始到平衡,甲醇的平均反应速率
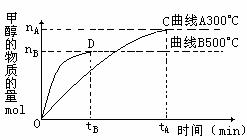 v(CH3OH)=nA/tAmol·(L·min)-1
v(CH3OH)=nA/tAmol·(L·min)-1
B.反应体系从300℃升温到500℃,平衡常数
K变化大
C.该反应的正反应为放热反应
D.处于C点的反应体系从300℃升高到500℃,
n(H2)/n(CH3OH)增大
(3)25℃,1.01×105Pa时,16g 液态甲醇完
全燃烧,当恢复到原状态时,放出369.2kJ的热量,次反应的热化学方程式为:
_____________________________________________________________________
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质是_______________;正极的电极反应式:_____________________________________。
 28.(14分)
28.(14分)
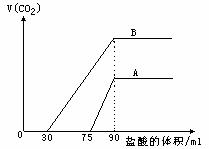
取来两份等浓度的NaOH溶液A和B,每份10ml,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,
试回答下列问题:
(1)原NaOH溶液的物质的量浓度为
_______________mol/L
(2)曲线A表明,原NaOH溶液中通入
CO2后,所得溶液中的溶质为(写
化学式)___________________;
其物质的量之比为_____________。
(3)曲线B表明,原NaOH溶液中通入
CO2后,所得溶液加盐酸产生CO2
气体体积(标准状况)的最大值为________________ml。
26. (14)分
(14)分
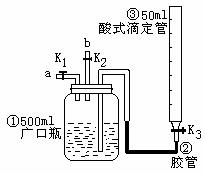
某活动小组利用右图进行NO、NO2的性质实验,按下
列步骤进行(装置气密性已检验完毕)。
I.向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加水的主要操作:____
__________________________ ____
_______________________________ _________.
(2)从导管a通入一定量的NO,并测得NO体积为VL
(V<50ml,气体体积已经换算为标准状况)。准确测得NO体积的主要操作________
___________________________________________________________________________。
II.验证NO的还原性;探究工业生产硝酸的原理
(1)停止通入NO后关闭K1、K3;打开K2,从导管b缓缓通入O2,可观察到的现象是
___________________________________________________________________________。
写出对应现象的化学方程式___________________________________________________。
(2)继续通入O2,打开K3,并及时调整酸式滴定管③液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
①当通入氧气的体积为1/2 V时,则广口瓶①的气体体积为_____________________;
②当广口瓶①中刚好充满液体时,所得液体的物质的量浓度为___________mol/L.
13.关于下列各装置图的叙述中,不正确的是

A.装置①中,d为阳极,c为阴极
B.装置②可用于收集H2,NH3,CO2,Cl2,HCl,NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,(NH3和HCl不溶于CCl4)并可防止倒吸
D.装置④可用于干燥、收集NH3并吸收多余的NH3
第26-28为必考题,每个试题考生都必须作答。第37-39为选做题,考生根据要求作答
12. 氯原子对O3分解有催化作用:O3+Cl=ClO+O2;△H1;ClO+O=Cl+O2;△H2,大气臭氧层的分解反应是:O3+O=2 O2 ;△H,该反应的能量变化示意如右图:下列叙述正确的是:
氯原子对O3分解有催化作用:O3+Cl=ClO+O2;△H1;ClO+O=Cl+O2;△H2,大气臭氧层的分解反应是:O3+O=2 O2 ;△H,该反应的能量变化示意如右图:下列叙述正确的是:
A.反应O3+O=2 O2的△H=E1-E3
B.反应O3+O=2 O2为放热反应
C.△H=△H1-△H2
D.大气层中的臭氧层无法再生
11. 镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用。电解质溶液为KOH溶液,电池反应为:Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2 ,下列有关镍镉电池的说法正确的是( )
镍镉(Ni-Cd)可充电电池在现代生活中有广泛的应用。电解质溶液为KOH溶液,电池反应为:Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2 ,下列有关镍镉电池的说法正确的是( )
A.放电时电池内部OH-向正极移动
B.放电时正极附近溶液的pH减少
C.充电时阳极反应为 Cd(OH)2+2e-=Cd+2OH-
D.充电时与直流电源正极相连的电极上发生Ni(OH)2 转化为NiO(OH)的反应
10.下列各溶液中,微粒的物质的量浓度关系正确的是 ( )
A.等体积等物质的量浓度的NaF与HF溶液混合:2c(Na+)=c(F-)+c(HF)
B.0.1mol/LpH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C.在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D.等物质的量浓度的(NH4)2SO4和(NH4)2CO3溶液中的c(NH4+):前者<后者
9.下列各项的两个量,其比值一定为2:1的是 ( )
A.液面在“0”刻度时,50ml碱式滴定管和25ml碱式滴定管所盛液体的体积
B.相同温度下,pH=1与pH=2的硫酸溶液中的c(H+)
C.在过氧化钠固体中,阳离子和阴离子的个数
D.在碳和浓硫酸(加热)的反应中,参加反应的硫酸与被还原硫酸的物质的量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com