
22.(12分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3-、Fe2+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
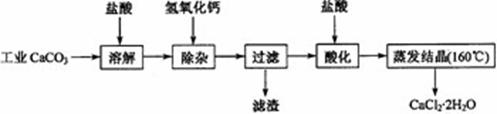
(1)除杂振作是加入氢氧化钙,调节溶液的pH为8.0~5.0,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完 全的实验振作是
。
全的实验振作是
。
(2)酸化振作是加入盐酸,调节溶液的pH约为4.0,起目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500g样品,溶解在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用0.0500 mol·L-1AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39mL。
①步骤a中配制250mL溶液所需要的玻璃仪器除了烧杯还有 。
②上述测定过程中需用溶液润洗的仪器有 。
③计算上述样品中CaCl2·2H2O的质量分数为 。
④若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),某同学认为偏高的原因可能是样品中存在少量的NaCl,要验证该同学的观点应进行的实验为
 (填实验名称)。
(填实验名称)。
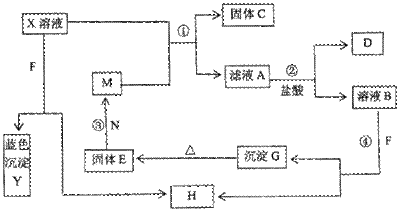 23.(12分)已知X为中学化学中的一种常见的盐,F为淡黄色固体:M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质、D为无色气体;在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
23.(12分)已知X为中学化学中的一种常见的盐,F为淡黄色固体:M、N为常见的金属,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承;H为气体单质、D为无色气体;在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
请回答下列问题:
(1)C、E的化学式分别为 、 。
(2)在反应①②③④中属于置换反应的是________________ (填序号)]
 (3)反应的离子方程式为________________。
(3)反应的离子方程式为________________。
(4)X溶液与F反应的总化学方程式为________________。
(5)若向100 mL盐X的溶液中加入10 g金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体C。则滤液A中溶质的物质的量浓度为________。(假设溶液体积不变)
21.(14分)由第一、第二周 期元素组成的几种物质,其组成分别如下:
期元素组成的几种物质,其组成分别如下:
 ①H2O、②H2O2、③CH3OH、④CO3、⑤NO2、⑥H2N-NH3(肼)、⑦F2。
①H2O、②H2O2、③CH3OH、④CO3、⑤NO2、⑥H2N-NH3(肼)、⑦F2。
回答下列问题:
(1)这些物质只具有18电子的分子有(填序号) 。
(2)若除去Na2SO4溶液中的Na2SO3,加入上述物质中的某种既环保,又不引进新的杂质。该物质的电子式为 。
(3)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验。在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:

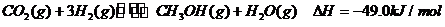
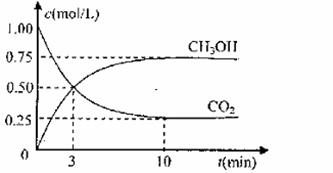 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 v(H2)= mol/(L·min)
v(H2)= mol/(L·min)
②该反应的平衡常数表达式为 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH。
(4)已知:N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ/mol
N2H(g)+O2(g)=N2(g)+2H2O(g)△H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
发射卫星时可用肼(H2N-NH2)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。肼和二氧化氮反应的热化学方程式为 。
有人认为若用氟代替二氧化氮用氧化 剂,则反应释放能量更大,肼和氟反应的热化学方程式:
剂,则反应释放能量更大,肼和氟反应的热化学方程式:
 。
。
20.将16gFeS与FeO的混合物,投入到含有1mol的硝酸溶液中充分反应,只产生1/3molNO气体,得到澄清的混合溶液。下列计算结果正确的是 ( )
A.混合物中含有0.5molFeS B.混合物中含有0.1mol FeO
C.参加反应的HNO3为1mol D.氧化产物Fe3+为0.15mol
第Ⅱ卷(非选择题 必做38分+选做12分,共50分)
18.下列说法正确的是 ( )
A.pH =6的纯水:c(H+)>c(OH-)
=6的纯水:c(H+)>c(OH-)
B.Na2CO3溶液中: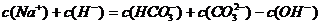
C.常温下0.1mol/L的下列溶液①NH2Al(SO4)2、②NH3Cl、③NH3·H2O、④CH3COONH4溶液中c(NH-4)由大到小的顺 序是:①>②>④>③
序是:①>②>④>③
D.完全中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的 NaOH物质的量相同
NaOH物质的量相同
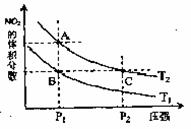 19.反应
19.反应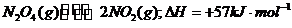 ,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
下列说法正确的是  ( )
( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相分子质量:A>C
17.关于下列图示的说法中正确的是 ( )

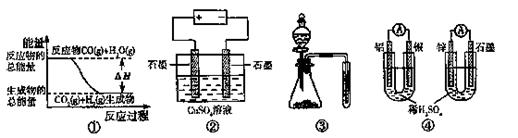
A .图①表示可逆反应:“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0
.图①表示可逆反应:“CO(g)+H2O(g) CO2(g)+H2(g)”中的△H大于0
B.图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1
C.图③实验装置可完成比较乙酸、碳酸、苯酚酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物 质的最也相同
质的最也相同
16.已知酸式盐NaHB在水溶液中存在下列反应:
①NaHB=Na++HB, ②HB H++B2,
H++B2,
③HB+H2O H2B+OH-且溶液中c(H-)>c(OH),则下列说法一定正确的是 ( )[来源:
H2B+OH-且溶液中c(H-)>c(OH),则下列说法一定正确的是 ( )[来源:
A.NaHB为强电解质
B.H2B为强酸
C.NaHB溶液中仅存在HB-、B2-两种含B元素的离子
D.HB-的电离程度小于HB-的水解程度[
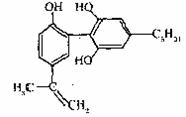
15.有一种兴奋剂的结构简式如右式、下列有关该物质的
说法正确的是 ( )
A.该分子中所有碳原子可以稳定的共存在一个平面中
B.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
C.1mol该物质与浓溴水和H2反应时,最多消耗Br2
和H2的物质的量分别为4mol、7mol
D.滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在的双键
14.现将足量AgCl分别入下列物质中,AgCl的溶解由大到小的排列顺序是 ( )
①20ml 0.01mol·L-1KCl溶液
②30ml 0.02mol·L-1CaCl2溶液
③40ml 0.03mol·L-1HCl溶液
④10ml蒸馏水
⑤50ml 0.05mol·L-1AgNO3溶液
A.①>②>③>④>⑤ B.④>①>③>②>⑤
 C.④>③>⑤>②>① D.⑤>④>②>①>③
C.④>③>⑤>②>① D.⑤>④>②>①>③
13.用N A表示阿伏加德罗常数的值。下列叙述正确的是 ( ) A.标准状况下,33.6L氯气通入足量水中,转移电
A表示阿伏加德罗常数的值。下列叙述正确的是 ( ) A.标准状况下,33.6L氯气通入足量水中,转移电 子数为1.5NA
子数为1.5NA
B.标准状况下,22.4L三氯甲烷中共价键数目为4NA
C.电解精炼铜时转移了NA个电子,则阳极溶解32g铜
D.合成氨反应平衡时,当1NAN≡N键形成同时,就有6NAN-H键形成
12.下列判断中一定正确的是 ( )
A.若R2-和M+的电子层结构上同,则原子序数:R>M
B.若X、Y都是气态氢化物,且相对分子质量:X>Y,则沸点:X>Y
C.若M,N是同主族元素,且原子序数:M>N,则非金属性:M>N
D.若XY2是离子化合物,则X与Y的原子序数不可能相差8
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com