
14.(1)SiO2 光导纤维 (2)SiO2 + 2OH- = SiO32- + H2O
(3)Si + 2Na2SiO3 + H2O = Na2SiO3 + 2H2↑ (4)SiO32- + 2H+ = H2SiO3↓
13.(1)SiO2+ 4Mg 2MgO + Mg2Si 放热 (2)SiH4
(3)SiH4 +2O2 = SiO2+2H2O
12.(1)①2MgO·SiO2 ②Al2O3·2SiO2·2H2O (2)N2O5·H2O CO·H2O N2O5 CO (3)FeCl2·2FeCl3 氯气的量不足(或铁过量)

11.BC
0.96 g残渣;
Ⅲ.将第三份试样隔绝空气加强热后,恰好生成一种固体,冷却后再加入足量的盐酸,该固体全部溶解,产生x L气体。
(1)单质A是_________。 (2)混合物中的B的质量分数为__________。
(3)写出实验Ⅲ中有关反应的化学方程式并计算x的值。
第42讲
典例解析
[例1]SiO2不溶于水也不与水反应,A项错误;C项中反应进行的原因是因为SiO2沸点高,利用不挥发性酸酐能把挥发性酸酐从它的盐中制取。而比较硅酸与碳酸的酸性强弱应看它们在溶液中发生的复分解反应的规律:较强酸制取弱酸,事实是:Na2SiO3 + CO2 + H2O = H2SiO3↓+ Na2CO3 ,则B项正确,C项错误;一般情况下,酸性氧化物不与酸反应,但也有特殊的,例:SiO2能与氢氟酸反应,则D项错误。故选B。
[例2]据化合价代数和为零可得:2m-3n-2=0 ,从而求出m 。本题答案选A。
[例3]B
当堂反馈:1.B 2.B 3.D 4.A 5.Si、Na2SiO3、H4SiO4、H2SiO3、SiO2
课后练习:1.C 2.B 3.B 4.A 5.A 6.B 7.C 8.A 9.D 10.AC
15.本题中所有的气体体积均指标准状况下的体积。A、B为两种单质,常温下均是固体。在元素周期表中,A、B两元素同周期且原子半径A>B。分别取三份质量为 1.52 g的A、B的混合物(粉末)进行如下实验:
Ⅰ.向第一份试样中加入过量的盐酸,充分反应后放出0.896 L气体,还余0.56 g残渣;Ⅱ.向第二份试样中加入过量的10% 的NaOH溶液,充分反应后放出0.896 L气体,还余
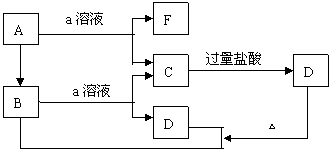
14.如下图所示的物质的转化关系中,A是一种固体单质,E是一种白色沉淀。据图填写:
(1)B的化学式是_________,目前B已被用作___________的主要原料。
(2)B和a溶液反应的离子方程式是_____________________________。
(3)A和a溶液反应的化学方程式是_____________________________。
(4)C和过量盐酸反应的离子方程式是____________________________。
13.把河沙(主要成分是SiO2)跟镁粉按一定质量比(质量比约大于15:24)混合均匀,装入试管中加热约1分钟后发生剧烈反应,生成一种白色固体化合物和一种硅化物。待生成的混合物冷却后放入盛有稀硫酸的烧杯中,立即产生气泡并伴有爆炸声,产生的气体是一种能在空气中自燃的气态氢化物。
(1)写出河沙与镁粉在加热条件下的发生反应的化学方程式_________________________,该反应是__________反应(填“放热”或“吸热”)。
(2)生成的混合物放入稀硫酸中,产生的气体是(填化学式)____________。
(3)写出产生爆炸声时发生反应的化学方程式________________________。
12.(1)将下列硅酸盐改写成氧化物的形式(改写时注意金属氧化物在前,非金属氧化物在后,低价在前,高价在后,H2O一般写在最后)。
①镁橄榄石(Mg2SiO4)____________;②高岭石[Al2Si2O5(OH)4]_____________。
(2)许多含氧酸及其盐类均可以类似地改写成氧化物形式,请继续改写下列物质:
HNO3___________;HCOOH__________。通过以上改写可知,HNO3的酸酐为______,HCOOH与浓H2SO4反应可制_________气体。
(3)已知在一定条件下,铁在氯气中燃烧可以生成Fe3Cl8 ,它可以看作是________(化学式)。生成该物质的条件可能是_______________________。
11.新型无机非金属材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等称为非氧化
物陶瓷,合成这些物质需要在高温条件下进行,在合成工艺中必须注意
A.通入充足的氧气 B.避免与氧气接触
C.可在氮的气氛中合成 D.通入少量氧气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com