
10. (14分)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2 CH3OH(g)
(14分)工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2 CH3OH(g)
(1)图1是反应时CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)= __________________
(2)图2表示该反应进行过程中能量的变化。曲线________(“a” 或“b”)表示不使用催化剂时反应的能量变化,曲线_________(“a” 或“b”)表示使用催化剂后的能量变化,写出反应的热化学方程式_________________________________________________
选择适宜的催化剂,______________(填“能”或“不能”)改变该反应的反应热。
(3)该反应平衡常数K的表达式为__________________________,
温度升高,K_________(填“增大” “不变” “减小”)
(4)恒容条件下,下列措施中能使 n(CH3OH)/n(CO) 增大的方法有______________
A. 升高温度 B.充入氦气
C. 再充入1molCO和2molH2 D.使用催化剂
(5)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的正极反应式和总反应的离子方程式:
正极反应式____________________________________
总反应离子方程式________________________________________________
天津一中2010届高三第四次月考
9.(18分)
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物,合成路线,反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO.
请根据所学知识与本题信息回答下列问题:
(1)写出阿司匹林分子式_______________
(2)请根据合成反应流程图
判断上述从前到后的各步的反应类型为_______________(填字母序号)
A. 加成、消去、加成、取代 B. 还原、消去、加成、水解
C. 还原、水解、加成、水解 D. 还原、水解、氯代、水解
(3)写出反应④的化学方程式___________________________________________________
(4)写出反应⑤的化学方程式__________________________________________________
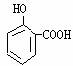 (5)已知 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共
(5)已知 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共
有____________种;写出其中核磁共振氢谱中有四个吸收峰的结构简式_____________
(6)请写出G的结构简式________________________
2.实验过程中,同学们发现上述装置存在以下问题,
①实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开其活塞,一会儿后稀硫酸不能顺利滴入锥形瓶。
②稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积
__________(填“偏高”、“偏低”或“无影响”)
③实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积
__________(填“偏高”、“偏低”或“无影响”)
于是他们设计了下图所示的实验装置。
装置中导管a的作用是_______________________________________
1. 同学们拟选用下列实验装置完成实验:
①你认为最简易的装置其连接顺序是:
A接( ) ( )接( ) ( )接( )(填接口字母,可不填满)
②实验结束时,在读取测量实验中生成氢气的体积时,你认为合理的是:
A.待实验装置冷却后再读数
B.上下移动量筒F,使其中液面与广口瓶液面相平
C.视线与凹液面最低点水平读取量筒中水的体积
2.过滤,洗涤,干燥,称量固体。该步骤中若未洗涤固体,测得镁的质量分数将_____________(填“偏高”、“偏低”或“无影响”)
请写出洗涤沉淀的具体操作方法:_____________________________________
方案二:将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20 oC,101KPa)的体积。
8.(18分)
镁铝合多已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
方案一:将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
实验中发生反应的化学方程式是______________________________________
实验步骤:1.称取5.4g铝镁合金样品,溶于VmL2.0mol/LNaOH溶液中,为使其反应完全,则NaOH溶液的体积V≥___________
7.(14分)有A、B、C三种短周期元素在周期表中相对位置如下:
|
A |
|
|
|
|
|
|
B |
C |
(1)A与B、A与C形成的液体化合物是常见的重要溶剂,则A、B、C三种元素最高价氧化物对应的水化物酸性由强到弱的顺序是:_________>_________>___________(用化学式表示)。
(2)B、C两种元素对应单质分别为X、Y。标准状况下,X的密度为3.17g/L。Z是一种化合物,焰色反应呈紫(透过钴玻璃), 0.1mol/L Z水溶液pH=13 。X、Y、Z有如图转化关系:
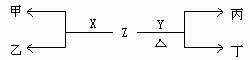
① 写出X与Z反应的离子方程式:______________________________________
② 已知丙能与稀硫酸反应生成使品红褪色的气体。
丁的化学式________________,
丁的水溶液pH>7原因______________________________________(用离子方程表示)
将20mL0.5mol/L丙溶液逐滴加入20mL0.2mol/L KMnO4(aq)(硫酸酸化)中,恰好褪色。写出反应的离子方程式__________________________________________
③ 石墨和铁做电极,用隔膜电解槽(不考虑产物之间相互反应)电解甲的溶液,阳极产生气体X,铁做________极,写出电解甲溶液的离子方程式__________________________
④ 实验室用含X元素的一种化合物E制取O2 ,工业上用无隔膜电解槽(考虑产物之间相互反应)电解甲的溶液生产化合物E,假设电解时电解槽进液口溶液中甲浓度为2mol/L,出液口溶液中甲浓度为1.6mol/L(进出口流量相同)则出液口溶液E浓度是____________mol/L 。
6.下列说法不正确的是:
A.0.1mol/LH2S溶液中,c(H+)>c(HS-)+c(S2-)+ c(OH-)
B.0.1mol/LCH3COONa溶液的pH=8,则 c(OH-)-c( CH3COOH)=1×10-8mol/L
C.pH与体积都相同的硫酸和醋酸溶液,分别与同物质的量浓度、同体积的Na2CO3溶液反应,若在相同条件下放出CO2的量相同,则Na2CO3恰好与醋酸完全反应或两种酸均过量。
D.将20mL0.4mol/L硝酸铵溶液和50mL0.1mol/L氢氧化钡溶液混合,混合溶液中各离子浓度的大小顺序是:c(NO3-)>c( Ba2+) >c(OH-)>c( NH4+)
II卷(60分) (请将答案写在答题纸上)
5.已知溶液中存在平衡: Ca(OH)2(s)  Ca2+ (aq) + 2OH-(aq) 下列有关该平衡体系的说法正确的是:
Ca2+ (aq) + 2OH-(aq) 下列有关该平衡体系的说法正确的是:
A.升高温度,平衡逆向移动
B.溶液中c(Ca2+ ) ·c2(OH--)恒为定值
C.向溶液中加入少量碳酸钠粉末能增大钙离子浓度
D.除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的氢氧化钠溶液
4.下述实验中不能达到预期实验目的的是:
|
编号 |
实验内容 |
实验目的 |
|
A |
C2H5Cl和NaOH溶液混合后振荡再加入AgNO3溶液 |
检验C2H5Cl中的Cl元素 |
|
B |
向沸腾的水中滴加FeCl3饱和溶液,继续煮沸至溶液呈红褐色为止 |
制备Fe(OH)3胶体 |
|
C |
室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 |
研究浓度对反应速率的影响 |
|
D |
室温下,用pH计测定浓度为0.1mol/LNaClO溶液CH3COONa溶液的pH |
比较HClO和CH3COOH的酸性强弱 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com