
19.(14分)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝处理,以有效避免或减缓钢铁
的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑
色氧化膜。发蓝处理过程可表示如下:
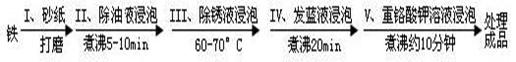
(1)步骤Ш用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反
应的化学方程式为___________________________________。
(2)为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液一段时间。如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),将观察到____________________________。
(3)工业生产中常常安排步骤V进一步处理经步骤Ⅳ处理后的铁件,以确保铁件表面微
小的松孔发生钝化作用。该过程利用了重铬酸钾(KCr2O7)的_______________(填化学性质)。
(4)除锈后的铁片在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),
发生了复杂的化学反应:
反应一:____Fe+____NaNO2+___NaOH-____Na2FeO2+____H2O+___NH3↑
反应二:8Fe+3NaNO3+5NaOH+2H2O=4Na2Fe2O4+3 NH3↑
反应三:Na2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH
①配平“反应一”的化学方程式(将系数直接填在横线上)。
②若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中加入_________
A.只需加入NaNO2 B.只需加入NaNO2和NaNO3
C.需要加入NaNO2、NaNO3和NaOH D.不需加入任何物质而直接使用
18.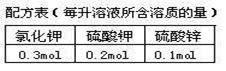 (10分)无土栽培试验时需要配制两份成分完全相
(10分)无土栽培试验时需要配制两份成分完全相
同的某营养液各1L,配方如右表。所配制的溶液
中,K+的物质的量浓度为__________________。
实验员在配完第一份溶液时发现,实验室的ZnSO4已经用完了,锌盐中只剩下了硝酸锌
(Zn(NO3)2)、氯化锌(ZnCl2)。请为实验员想想如何都能配得第二份营养液(将所需溶质的物质的量填入下列横线中,若不需要某溶质,则在对应横线上填上“0”)。
KCl_____________、K2SO4_____________、Zn(NO3)2_______________、ZnCl2___________
17.(13分)NO2与Na2O2常温下能反应。反应时何者为氧化剂?两同学开展如下研究。
[作出猜想]甲乙同学对反应如何进行有如下猜想:
猜想一:Na2O2+2NO2=2NaNO2+O2↑
猜想二:2Na2O2+4NO2=4NaNO3
 [查阅资料]2Na2O2+2H2O=4NaOH+O2↑
[查阅资料]2Na2O2+2H2O=4NaOH+O2↑
2NO2+2NaOH=NaNO2+NaNO3+H2O
2NaNO2+2HCl=2NaCl+NO↑+NO2↑+H2O
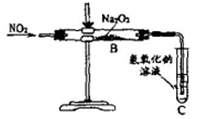
[实验探究]a.按图示实验装置开展实验。实验时,往装置中通入足量的NO2,直至反应停止;b.取反应后玻璃直管中固体物质于试管中进行如下实验,并观察、记录现象:
|
实验操作 |
实验现象 |
|
|
|
[实验结论]现象表明,Na2O2与NO2反应按“猜想二”进行。
回答下列问题:
(1)实验时,利用铜与浓硝酸制取NO2,反应方程式为________________________。
(2)装置C的作用是____________________________。
(3)根据实验结论,NO2与Na2O2反应时作氧化剂的物质是_______________。
(4)请根据实验目的要求和实验结论,将“实验探究”栏目中的表格填写完整。
(5)甲乙同学都认为,不宜直接观察C装置导管口是否有气泡冒出即可判断Na2O2与NO2反应究竟按哪种猜想进行。其原因是________________________________________。
第Ⅱ卷(综合能力测试,共50分)
16.(10分)水污染问题是当前全世界关注的焦点问题。我们每一个人都应该自觉地保护水资源,防止污水的随意排放。比如,实验过程中产生的废水不能随意倒入下水道。已知某次化学实验后,回收的废液中可能含有K+、Cu2+、Ag+等离子。
(1)为检验废水中是否含有Ag+,可以采用的试剂是________________。如果溶液中确实存在Ag+,加入试剂后,将观察到的现象是____________________________,反应的离子方程式为__________________________。
(2)实验证明,废液中确实存在上述三种离子。为回收Cu、Ag两种金属,实验时可以加
入足量的__________(填物质名称),充分反应后,经过_________(填实验操作名称),
可得到Cu和Ag。经过上述处理后的废水,进一步处理后即可以排放。
15.(12分)某化工厂用氯气与氢氧化钙生产漂白粉。该厂出厂产品说明书如下:
 (1)漂白粉的有效成分是_______________(填化学式).
(1)漂白粉的有效成分是_______________(填化学式).
(2)化工生产中Cl2来源于电解食盐水。电解过程中,阳极反应为2Cl--2e-=Cl2↑,阴极反应为2H2O+2e-=2OH-+H2↑。则电解时阳极发生_________(填“氧化”或“还原”)反应。
(3)生产漂白粉原理是(用化学方程式表示)_________________________________。
(4)“密封避光保存于阴凉处,随用随配”是因为漂白粉有效成份与空气中CO2、H2O反
应生成不稳定的次氯酸而易失效。生成次氯酸的化学方程式为_______________________。
(5)某次配制中,取一定质量漂白粉溶解于1000g水中,所得溶液次氯酸钙和氯化钙的物质的量浓度均为0.01mol/L。假设漂白粉不含其它杂质,且所得溶液的体积仍为1L,则此次溶液配制中,所加漂白粉的质量为__________g。
14.(9分)为完成实验,有下列可供选择的实验方案:
A.与消石灰共热,并将湿润红色石蕊试纸置于试管口
B.先加入足量的稀硝酸,再滴入适量BaCl2溶液
C.加入足量氢氧化钠溶液直至过量,充分反应后过滤
D.加入足稀硫酸溶液直至过量,充分反应后过滤
E.先加入足量的稀盐酸,再滴入适量BaCl2溶液
根据实验要求,选择合适方案填入I中,并根据所选方案所产生的主要现象填入Ⅱ中。
|
实验要求 |
证明亚硫酸钠氧化变质 |
证明某白色固体中含有NH4+ |
除去铁粉中少量铝粉 |
|
|
答案 |
Ⅰ |
|
|
|
|
Ⅱ |
|
|
|
13.(8分)(1)我国政府规定食用盐中必须加入一定量的KIO3(碘酸钾),其中碘元素的化合
价为 价。
(2)海水中镁的总储量约为2×1015 t,目前世界上生产的镁有60%来自海水,海水中的镁
元素处于 (填“游离态”或“化合态”),从海水中提取氯化镁 (填
“属于”或“不属于”)氧化还原反应。
(3)玻璃、水泥、陶瓷都是硅酸盐工业产品,这三类物质中一定含有的元素是 。
12.下列叙述中,正确的是 ( )
A.氨气喷泉实验说明氨气极易溶解于水
B.NaHCO3的热稳定性比Na2CO3强
C.过量铁粉加入CuCl2溶液中,充分反应后溶液中的阳离子主要是Fe3+
D.氯气中含有的少量氯化氢,可用氢氧化钠溶液除去
11.下列关于浓硫酸的叙述正确的是 ( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.稀释浓硫酸时,先将浓硫酸加入烧杯中,再加入水并搅拌
C.浓硫酸是一种干燥剂,能够干燥氨气、氧气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
10.下列现象与胶体知识无关的是
A.日常生活中看到的云、烟、雾
B.蒸发饱和食盐水析出氯化钠晶体
C.向豆浆中加入盐卤做豆腐
D.一束平行光线射入蛋白质溶液里,从侧面可以看到一束光亮的通路
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com