
10. 钢铁制品经常进行烤蓝处理,即在铁制品的表面生成一层致密的Fe3O4。某学习小组为了研究烤蓝铁片,分别进行了以下实验操作:
⑴把一定量烤蓝铁片加工成均匀粉末。
 ⑵取m g该粉末,放人28.00 mL 1 mol/L。的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。则:反应后溶液中的溶质是
(写化学式),m=
。
⑵取m g该粉末,放人28.00 mL 1 mol/L。的盐酸中,恰好完全反应,生成标准状况下的气体134.4 mL,向溶液中滴入KSCN溶液,无明显现象。则:反应后溶液中的溶质是
(写化学式),m=
。
⑶再取三份不同质量的粉末,分加加到相同体积(V)、物质的量浓度均为l0.00 mol/L的三份硝酸溶液中,充分反应后,固体全部溶解,有关的实验数据如下表所示(假设NO是硝酸的唯一还原产物):
|
实验序号 |
Ⅰ |
Ⅱ |
Ⅲ |
|
加入粉末质量/g |
13.68 |
27.36 |
34.20 |
|
生成气体的体积(标准状况)/L |
2.912 |
5.824 |
6.720 |
 ①试计算每份硝酸溶液的体积(V)是多少?
①试计算每份硝酸溶液的体积(V)是多少?
②若向实验Ⅱ所得溶液中继续加入铜粉,要使溶液中Cu2十、Fe2+、Fe3+同时存在,则加入铜粉的物质的量范围是 。
0.2 0.1 0.2 14.2 14.2 14.2 27.4 27.4
n(CaCO3)=27.4 mol;n(C)=14.4 mol;
∴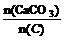 =1.90················································(4分)
=1.90················································(4分)
解二:由电子守恒法计算,略。
9. (1)425.6····························(1分)
(2)y=(176x+24)×22.4 m3·········(2分)
图像如右图:·····················(1分)
(3)解一:设窑气为100 mol,则n(N2)=100-41.6-0.2-0.2=58 mol,总共有n(O2)=58/4=14.5 mol;故参加反应的n(O2)=14.5 mol-0.2 mol=14.3 mol;
2C + O2 = 2CO C + O2 = CO2 CaCO3=CO2↑+CaO
2 1 2 1 1 1 1 1
9. 工业上利用焦炭在石灰窑中燃烧放热,使石灰石分解生产CO2:
|
CaCO3 CO2↑+CaO·············②
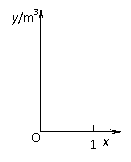 (1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为 ▲ m3。
(1)含碳酸钙95%的石灰石2.0 t按②完全分解(设杂质不分解),可得标准状况下CO2的体积为 ▲ m3。
(2)纯净的CaCO3和焦炭混合物2.4 t按①、②完全反应。若焦炭的质量分数为x,在石灰窑中充分反应生成标准状况下的CO2气体共y m3。写出y关于x的函数关系式 ▲ ,并在右图中绘出示意图(注明起始等重要点的坐标)。
(3)某次窑气体积分数如下:O2 0.2%、CO 0.2%、CO2 41.6%,其余为N2。则此次窑内配比率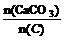 = ▲ (保留1位小数,设空气只含N2与O2,且体积比为4∶1)。
= ▲ (保留1位小数,设空气只含N2与O2,且体积比为4∶1)。
8. (1)192kg(2)1∶10 (3)227.6kg
8. 以天然气为原料合成氨是新的生产氮肥的方法,它具有污染小、成本低等诸多特点,其过程大体如图,某工厂以标准状况下的含CH489.6%的天然气100m3为原料经过上述过程,生产尿素和硝酸铵。
 (1)合成氨生产过程中氨的产率为60%,假设其他各步反应均完全且不考虑副反应,求100m3的天然气可生产尿素的质量。
(1)合成氨生产过程中氨的产率为60%,假设其他各步反应均完全且不考虑副反应,求100m3的天然气可生产尿素的质量。
(2)为使硝酸生产过程中不再补充空气,假设各步反应均完全且氨中氮元素全部转化为HNO3,空气中氧气体积分数设为20%,求由氨气和空气组成的原料气中(不包含被硝酸吸收的氨气)氨气与空气的体积比。
(3)实际生产中,若氨的产率为60%,硝酸的产率为80%,求100m3的天然气最多可生产硝酸铵的质量。

7. [探究一](1) 2 (2分) (2)②③ (2分) (3)A (2分)
[探究二]当0<x≤1/3;V=10-10x (2分) 当1>x>1/3;V=5+5x (2分)
7. 丁烷在一定条件下可以按两种方式裂解:C4H10→C2H6+C2H4;C4H10→CH4+C3H6,
某石油公司实验室对丁烷进行裂解后的裂解气进行研究。
[探究一]裂解气的系列问题
(1) 若将1mol丁烷进行完全裂解,则最终所得混合气的物质的量为 mol。
(2) 若丁烷部分裂解,则反应后混合气体平均相对分子质量可能是 (填编号)
①28.5 ②42 ③51 ④60
(3) 将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,
且产物均为气体(101kPa,120℃),其总质量为72g,
下列有关叙述不正确的是( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则压强变为吸收前的1/3
D.反应中消耗的氧气为56g
[探究二]测量裂解气与H2加成反应后气体总体积与氢气的体积分数关系
(4)另取丁烷完全裂解后的气体与H2的混合气体10L,已知其中H2的体积分数为x,在一定条件下使其充分反应,反应后气体的体积为V L。请列出V与x的函数关系式。
(无需解答过程)
6. Ⅰ⑴不完全,(1分);CO,(1分);CO2+C高温2CO 或 CuO+C高温Cu+CO↑ (1分);
Ⅰ⑴不完全,(1分);CO,(1分);CO2+C高温2CO 或 CuO+C高温Cu+CO↑ (1分);
⑵ 7.4g,(1分); 0.025 mol(1分)
Ⅱ、⑴ 解:依题意,m g X中:n(Cu)∶n(Fe)=1∶1
2n(Cu2+) +3n(Fe3+) =6.05mol·L-1×0.2L×2-1 mol·L-1×2.12L
故:n (Cu) = n (Fe) = 0.06mol
 又,n (S) = 0.6mol·L-1×0.1L×2 = 0.12mol
又,n (S) = 0.6mol·L-1×0.1L×2 = 0.12mol
因此,m g = m(Cu) + m(Fe) + m(S)
= 0.06mol×64g·mol-1+0.06mol×56g·mol-1+0.12mol×32g·mol-1= 11.04g
即m 的值为11.04 (3分)
⑵ 解:设X的化学式为(CuFeS2)n,则
(64+56+32×2)×n = 368 n = 2故X的化学式为Cu2Fe2S4 (3分)
6. 铜是人类最早知道的金属之一,实验室可用C、H2还原CuO制取少量的Cu,工业上主要用火法从黄铜矿中提炼Cu。
Ⅰ(6分)实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合加热,将反应生成的气体通过足量的澄清石灰水并集气。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
⑴ 上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气
体是 (填写化学式),产生这种气体的化学方程式为:
。
⑵ 反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的
量为 mol。
 Ⅱ. 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
Ⅱ. 黄铜矿的主要成分X是由Cu、Fe、S三种元素组成的复盐,其中Cu、Fe两种元素的质量比为8∶7;将m g X粉末全部溶于200 mL的浓HNO3,反应后的溶液加水稀释至 2.12 L时测得其pH为0;将稀释后的溶液分为两等份,向其中一份溶液中滴加6.05mol/L的NaOH溶液,向另一份溶液中滴加0.600mol/L Ba(NO3)2溶液,两溶液中均生成沉淀,且沉淀的质量随所加溶液的体积变化如下图所示:
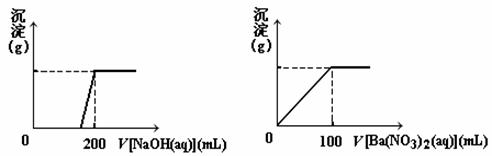
⑴ 请通过计算确定m的值;
 w.w.w.k.s.5.u. c.o.m
w.w.w.k.s.5.u. c.o.m
⑵ X的摩尔质量为368 g/mol,请确定X的化学式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com