
3.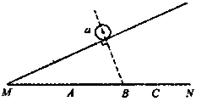 如图,把一带正电的小球a放在光滑绝缘面上,欲使球a能静止在斜面上,需在MN间放一带电小球b,则b应( )
如图,把一带正电的小球a放在光滑绝缘面上,欲使球a能静止在斜面上,需在MN间放一带电小球b,则b应( )
A.带负电,放在A点
B.带正电,放在B点
C.带负电,放在C点
D.带正电,放在C点
2. 如图所示,OP为足够长的水平挡板,其下方有垂直纸面向里的匀强磁场,磁场范围足够大。S为一质子源,它可以向a、b、c、d四个垂直磁场的方向发射速率相同的质子,ac垂直于OP,bd平行于OP。不计质子重力,则最有可能击中挡板的是( )
如图所示,OP为足够长的水平挡板,其下方有垂直纸面向里的匀强磁场,磁场范围足够大。S为一质子源,它可以向a、b、c、d四个垂直磁场的方向发射速率相同的质子,ac垂直于OP,bd平行于OP。不计质子重力,则最有可能击中挡板的是( )
A.a B.b C.c D.d
1.下列说法中正确的是( )
A.一小段通电导线在某处不受磁场力作用,则该处磁感应强度一定为零
B.由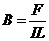 可知,磁场中某点的磁感应强度与一小段通电导线在该点受到的安培力成正比
可知,磁场中某点的磁感应强度与一小段通电导线在该点受到的安培力成正比
C.同一电场中等势面分布越密的地方,场强一定越大
D.电荷在电场中某点受到的电场力方向一定与该点的电场强度方向相同
13. [命题意图]
以C与CuO在高温下的反应为载体,结合有效碰撞碰理论,指引学生了解固相物质与固相物质之间在一定条件下发生的反应的不完全性,打破学生的思维定势,树立正确的认识。同时多方面考查守恒思想在化学计算中的合理应用,锻炼学生思维的敏锐性。
13. 实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合,加热后将反应生成的气体通过足量的澄清石灰水。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
实验证明,C还原CuO时既可能生成Cu,也可能生成Cu2O,即使在C过量时,实验中CuO也可能部分未被还原。为了测定某次实验产物的组成,取1.2 g C跟8.0 g CuO混合,加热后将反应生成的气体通过足量的澄清石灰水。一段时间后停止加热,共收集到560 mL气体(已经折算成标准状况),测得沉淀的质量为2.5 g。则:
⑴ 上述实验中C (填“完全”或“不完全”)参加反应,实验中收集到的气体是 (填写化学式),产生这种气体的化学方程式为 。
⑵ 反应后得到的固体混合物总质量为 ,其中含氧化合物的物质的量为 。
⑶被还原生成Cu2O的CuO占总CuO的物质的量分数为x,试通过计算求出反应中生成Cu的质量[m(Cu)]与x的关系。
 ⑷ 请在右图中画出m随x变化的图像。
⑷ 请在右图中画出m随x变化的图像。
12. (1)电池总反应为 2Na+xS Na2Sx
正极反应式:xS+2e-=Sx2-
负极反应式:2Na-2e-=2Na+
(2)电解混合溶液时,
阳极先后发生下列反应:
2Cl--2e-=Cl2↑;4OH--4e-=2H2O+O2↑
阴极先后发生下列反应:
Cu2++2e-=Cu;2H++2e-=H2↑
由于消耗23gNa,电路中有1mol电子转移,即阳极,阴极均消耗1mol电子。
对于阳极:使Cl-全部放电产生0.1mol Cl2耗0.2mol e-,另有0.8mol e-使OH-放电产生O2 0.2mol。
共产生气体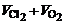 =0.3mol×22.4L·mol-1=6.72L
=0.3mol×22.4L·mol-1=6.72L
对于阴极:使Cu2+全部放电需耗0.4mol e-,另有0.6mol e-使0.6mol H+放电。
比较阴极、阳极,有0.6mol H+、0.8mol OH-分别放电,故溶液中产生0.2mol H+
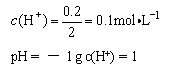
12. 目前人们正在研究开发一种高能电池--钠硫电池,它是以熔融的钠、硫为两
 极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应式为:2Na+xS Na2Sx
极,以Na+导电的β-Al2O3陶瓷作固体电解质,反应式为:2Na+xS Na2Sx
(1)电池放电时正负极的电极反应式:
 正极反应式:___________________;负极反应式:____________________。
(2)用该电池作电源进行电解含有0.2mol CuSO4和0.2molNaCl的混合溶液500ml时:若 此电池工作一段时间后消耗23g Na 。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
正极反应式:___________________;负极反应式:____________________。
(2)用该电池作电源进行电解含有0.2mol CuSO4和0.2molNaCl的混合溶液500ml时:若 此电池工作一段时间后消耗23g Na 。则阳极产生气体体积为:________L(标准状况下);电解后溶液加水稀释至2 L ,溶液的pH为:________。
11. 解:⑴ 设反应①中乙烯的投料为x,则得到乙酸为x×75%×80%
设反应②中乙烯的投料为y,则有
x×75%×80%×75%∶y×75%=2∶2
x∶y=5∶3 (3分)
⑵ 2.8×106kg×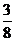 ×75%×
×75%×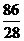 =2.42×106kg (3分)
=2.42×106kg (3分)
⑶ 设反应①中投入乙烯为5a,则反应中投入乙烯为3a
反应①中最少消耗氧气2.5a,生成乙醛0.75×5a=3.75a
反应②中最少消耗氧气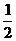 ×3.75a=1.875a
×3.75a=1.875a
反应③中最少消耗氧气1.5a
即最少共消耗氧气:5.875a,相当于5.875a×5=29.375a
通入的空气与乙烯的体积比的最小值为29.375a∶8a=3.68 (4分)

11. 醋酸乙烯酯是合成维尼纶的重要单体,某化工厂利用下列反应原理生产醋酸乙烯酯:
2CH2=CH2+O2 2CH3CHO ……………………①
2CH3CHO ……………………①
2CH3CHO+O2 2CH3COOH ……………………②
2CH3COOH ……………………②
2CH2=CH2+O2+2CH3COOH 2CH3COOCH=CH2 ……………③
2CH3COOCH=CH2 ……………③
由于副反应的发生,反应①中乙烯的利用率为75%,反应②中乙醛的利用率为80%,反应③中乙酸与乙烯的利用率均为75%。
⑴ 为使醋酸乙烯酯获得最大产量,乙烯先后两次的投料比为 ;
⑵ 以2.8×106kg乙烯为原料,最多可制得醋酸乙烯酯 kg;
⑶ 若各步副反应中反应物物质的量之比均与主反应相同,以乙烯和空气为原料,生产醋酸乙烯酯。计算:通入的空气(O2的体积分数为1/5)与乙烯的体积比的最小值。
10. ⑵FeCl2 0.912 g
⑶①0.180 L(或180 mL)
②0.105mol<n(Cu)<0.315mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com