
5.(1)用18 mol/L的硫酸配制100 mL 1.0 mol/L的硫酸,若实验仪器有:A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.25 mL酸式滴定管 F.胶头滴管 G.50 mL烧杯H.100 mL容量瓶
实验时所需仪器的先后顺序是(填入编号)__________________________。
(2)在容量瓶的使用方法中,下列操作不正确的是(填写编号)__________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近标线1 cm-2 cm处,用滴管滴加蒸馏水到标线
D.配制溶液时,如果试样是液体,用滴定管量取试样后直接倒入容量瓶中,缓慢加入蒸馏水到接近标线1 cm-2 cm处,用滴管滴加蒸馏水到标线
E.盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转或摇动多次
 答案(1)G、E、C、H、F或E、G、C、H、F (2)B、C、D
答案(1)G、E、C、H、F或E、G、C、H、F (2)B、C、D
4.配制0.1 mol/L的NaCl溶液,下列操作会导致所配溶液浓度偏高的是 ( )
A.称量时,左盘高,右盘低 B.定容时俯视读取刻度
C.原容量瓶洗净后未干燥 D.定容时液面超过了刻度线
答案 B
3. 以下各组溶液中Cl-的物质的量浓度与300 mL 1 mol/L NaCl溶液中Cl-的物质的量浓度相同的是 ( )
A.100 mL 1 mol/L AlCl3溶液 B.200 mL 1 mol/L MgCl2溶液
C.100 mL 0.5 mol/L CaCl2溶液 D.100 mL 2 mol/L KCl溶液
答案 C
2.两种硫酸溶液,一种硫酸溶液的物质的量浓度为c1,密度为ρ1;另一种硫酸溶液的物质的量浓度为c2,密度为ρ2,将它们等体积混合后,所得溶液的密度为ρ3,则混合后硫酸的物质的量浓度为
( )
A.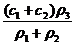 B.
B. 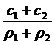 C.
C.
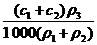 D.
D. 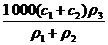
答案 A
1.设NA为阿伏加德罗常数的值,下列关于0.2 mol/L的Ba(NO3)2溶液不正确的说法是 ( )
 A.2 L溶液中的阴、阳离子总数为0.8NA
A.2 L溶液中的阴、阳离子总数为0.8NA
B.500 mL溶液中NO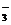 浓度为0.2 mol/L
浓度为0.2 mol/L
C.500 mL溶液中Ba2+浓度为0.2 mol/L
D.500 mL溶液中NO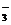 总数为0.2NA
总数为0.2NA
答案 AB
4.体积为V mL,密度为ρ g· mL-1的含有相对分子质量为M的某物质的溶液,其中溶质为m g,其物质的量浓度c mol/L,溶质的质量分数为w%,则下列表示正确的是 ( )
A.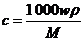 B.
B.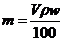 C.
C.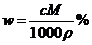 D.
D.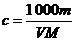
答案 BD
3.(2008·合肥三模)有硫酸镁溶液500 mL,它的密度是1.20 g·cm-3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是 ( )
A.溶质的质量分数是24.0% B.溶液的物质的量浓度是2.4 mol/L
C.溶质和溶剂的物质的量之比是1∶40 D.硫酸根离子的质量分数是19.2%
答案 C
2.若以w1和w2分别表示浓度为a mol/L和b mol/L硫酸的质量分数,且知2a=b,则下列推断正确的是(硫酸的密度比纯水的大) ( )
 A.2w1= w2
B.2 w2= w1
C. w2>2 w1
D. w1< w2<2 w1
A.2w1= w2
B.2 w2= w1
C. w2>2 w1
D. w1< w2<2 w1
答案 D
[例3]在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g· cm-3,质量分数为w,物质的量浓度为c mol/L,溶液中含氢氧化钠质量为m g。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为____________________。
(2)用m、V表示溶液中溶质的物质的量浓度(c)为_________________。
(3)用w、d表示溶液中溶质的物质的量浓度(c)为___________________。
(4)用c、d表示溶液中溶质的质量分数为___________________。
答案(1)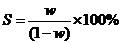 (2)
(2)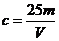 mol/L (3)c=25dw mol/L (4)
mol/L (3)c=25dw mol/L (4)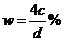
[例4]质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水。得到的溶液每毫升质量为q g,且其物质的量浓度为c mol/L。则溶质的相对分子质量为 ( )
A.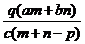 B.
B.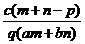
C.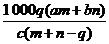 D.
D.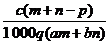
答案 C
1.(1)已知H2SO4溶液的浓度越大密度也越大,40%的H2SO4溶液和50%的H2SO4溶液等质量混合后,所得溶液溶质的质量分数__________(“大于”“小于”或“等于”)45%;如果是等体积混合,混合以后所得溶液溶质的质量分数________(“大于”“小于”或“等于”)45%。
(2)已知98%的浓H2SO4溶液的物质的量浓度为18.4 mol/L,试判断49%的H2SO4溶液的物质的量浓度______(“大于”“小于”或“等于”)9.2 mol/L,通过计算说明依据。
答案 (1)等于 大于 (2)小于 由c与m%的转化关系知:
①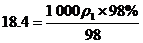 ②
②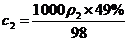 ①÷②式知:
①÷②式知: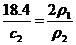
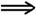 ∵ρ1>ρ2,∴
∵ρ1>ρ2,∴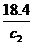 >2,即2c2<18.4? c2<9.2。
>2,即2c2<18.4? c2<9.2。
4.实验室配制500 mL 0.2 mol/L的FeSO4溶液,实验操作步骤有:
①在天平上称出27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水使它完全溶解
②把制得的溶液小心地注入500 mL容量瓶中
 ③继续向容量瓶中加蒸馏水至液面距刻度1-2 cm处。改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
③继续向容量瓶中加蒸馏水至液面距刻度1-2 cm处。改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切
④用少量蒸馏水洗涤烧杯和玻璃棒2-3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白:
(1)操作步骤和正确顺序为(填序号)_________________________。
(2)本实验用到的基本仪器有_____________________________________。
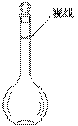
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会_____________
(填“偏高”、“偏低”或“无影响”)。
(4)若出现如下情况,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会_____________;加蒸馏水时不慎超过了刻度,会__________。
 (5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应_______________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应_________________________________。
(5)若实验过程中出现如下情况应如何处理?加蒸馏水时不慎超过了刻度,应_______________;向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面,应_________________________________。
答案(1)①②④③⑤ (2)天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管(3)偏高
(4)偏低偏低 (5)宣告实验失败,从头重新做 宣告实验失败,从头重做
[例1](2008·长沙模拟)已知14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将 ( )
A.大于40% B.等于40%
C.小于40% D.无法确定
答案 A
[例2]对于1 mol/L的氨水,下列叙述正确的是(忽略溶液混合时的体积变化) ( )
A.将标准状况下22.4 L氨气溶于1 L水中配成溶液,即可得1 mol/L的氨水
B.1 mol/L的氨水的质量分数小于1.7%
C.将1 mol/L的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5 mol/L
D.质量分数为10%的氨水与质量分数为20%的氨水等体积混合,所得氨水的质量分数小于15%
答案 CD
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com