
8.配制100 mL 1 mol/L氢氧化钠溶液,下列操作错误的是 ( )
A.在托盘天平上放两片大小、质量一样的纸,然后将氢氧化钠放在纸片上进行称量
B.把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中
C.用蒸馏水洗涤烧杯、玻璃棒各2-3次,洗涤液也移入容量瓶中
D.沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹面恰好与刻度相切
答案 AD
7.(2008·杭州模拟)t℃时,将w g化合物A放入水中充分溶解,制得Y g饱和溶液,化合物A的相对分子质量为M,饱和溶液密度为d g·cm-3,其质量分数a%,t℃时,A的饱和溶液的物质的量浓度为 ( )
A.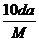 mol/L
B.
mol/L
B.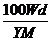 mol/L
C.
mol/L
C.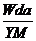 mol/L
D.
mol/L
D.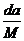 mol/L
mol/L
答案 A
6.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是 ( )
 ①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②用滴定管量取液体时,开始时平视读数,结束时俯视读数③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ④转移溶液前容量瓶内有少量蒸馏水⑤定容时,仰视容量瓶的刻线⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻线
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 ②用滴定管量取液体时,开始时平视读数,结束时俯视读数③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤 ④转移溶液前容量瓶内有少量蒸馏水⑤定容时,仰视容量瓶的刻线⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻线
A.①③⑤⑥ B.①②⑤⑥
C.②③④⑥ D.③④⑤⑥
答案 A
5.已知某饱和溶液的以下条件:①溶液的质量 ②溶剂的质量 ③溶液的体积 ④溶质的摩尔质量 ⑤溶质的溶解度 ⑥溶液的密度,其中不能用来计算该饱和溶液的物质的量浓度的组合是 ( )
A.④⑤⑥ B.①②③④
C.①③④ D.①③④⑤
答案 C
4.在标准状况下的a L HCl(g)溶于1 000 cm3水中,得到的盐酸密度为b g·cm-3,则该盐酸的物质的量浓度是 ( )
A.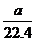 mol/L
B.
mol/L
B.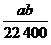 mol/L
mol/L
C.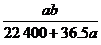 mol/L
D.
mol/L
D.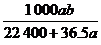 mol/L
mol/L
答案 D
3.实验中需用2.0 mol/L的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为 ( )
A.950 mL;201.4 g B.1 000 mL;212 g
C.100 mL;21.2 g D.500 mL;100.7 g
答案 B
2.下图分别表示四种操作,其中有两处错误的是 ( )
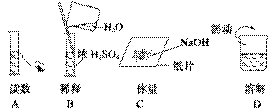
答案 B
1. 若20 g密度为d g· cm-3的Ca(NO3)2(aq)里含有1 g
Ca2+,则NO
若20 g密度为d g· cm-3的Ca(NO3)2(aq)里含有1 g
Ca2+,则NO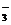 的浓度是
( )
的浓度是
( )
A.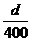 mol/L
B.
mol/L
B.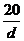 mol/L
mol/L
C.2.5d mol/L D.1.25d mol/L
答案 C
7.实验室需要配制0.50 mol/L NaCl溶液480 mL。
(1)按下列操作步骤填上适当的文字,以使整个操作完整。
第一步:选择仪器。完成本实验所必需的仪器有:天平(精确到0.1 g)、药匙、____________、_______________、___________________、_________________________以及等质量的两片滤纸。第二步:计算。配制该溶液需取NaCl晶体____________________________g。
第三步:称量。
 ①天平调平之后,应将天平的游标调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
①天平调平之后,应将天平的游标调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
②称量过程中NaCl晶体应放于天平的__________________________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入___________________________中。
 第四步:______________________,该步实验中还需进行的动手操作是_______________________。第五步:转移、洗涤。在转移时应使用_________________引流,
第四步:______________________,该步实验中还需进行的动手操作是_______________________。第五步:转移、洗涤。在转移时应使用_________________引流,
需要洗涤2-3次是为了_______________________。
第六步:_____________________。
第七步:_____________________。
第八步:将配好的溶液静置一段时间后,倒入指定的试剂瓶,
并贴好标签,注明配制的时间、名称及浓度。
(2)在配制过程中,某学生观察定容时液面情况如图所示,
所配溶液的浓度会_______________________(填“偏高”“偏低”或“无影响”)。
答案 (1)烧杯 玻璃棒 500 mL容量瓶 胶头滴管 14.6
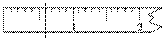 ①
①
②左盘 ③烧杯 溶解 用玻璃棒搅拌,加速NaCl溶解 玻璃棒 减少NaCl流失,减小实验误差 定容 摇匀
(2)偏高
备用实验1 化学实验中的数据处理
 试题设计
试题设计
(1)准确量取25.00 mL高锰酸钾溶液,可选用的仪器是 ( ) A.50 mL量筒 B.500 mL量筒
C.50 mL酸式滴定管 D.50 mL碱式滴定管
答案 C
(2)某同学在实验报告中记录了下列数据,其中一定不正确的是 ( )
A.用广泛pH试纸测得某醋酸溶液的pH为3
B.用托盘天平称取某未知物的质量为18.48 g
C.用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液22.60 mL
D.用10 mL的量筒量取了5.2 mL的无水酒精
答案 B
(3)下列实验操作会导致实验结果偏低的是 ( )
①配制100 g 10%的CuSO4溶液,称取10 g CuSO4晶体溶于90 g水中 ②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮 ③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g,所得溶液的浓度 ④用98%,密度为1.84 g/cm3的浓H2SO4配制1∶5稀H2SO4时,把14 g 98%的浓H2SO4溶于54 g水中
A.只有① B.只有② C.②③④ D.①③④
答案 D
(4)现有KCl和KNO3的混合物,某同学分别称取一定质量的样品,并加入同浓度的AgNO3溶液,对该样品进行了分析,其实验数据如下表。下列对该数据分析不正确的是 ( )
|
实验编号 |
① |
② |
③ |
|
样品质量(g) |
15.6 |
7.8 |
7.8 |
|
AgNO3溶液质量(g) |
100 |
100 |
150 |
|
生成沉淀的质量(g) |
14.35 |
14.35 |
14.35 |
A.实验②所用KCl与AgNO3溶液刚好反应
B.根据表中数据能求出KCl的质量分数
C.混合液过滤后得到的滤液均含两种或两种以上溶质
D.对该实验的数据分析利用了比较法
答案 C
6.常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。计算:
(1)该混合溶液中NaCl的质量分数____________________________________。
(2)该混合溶液中NaCl的物质的量浓度________________________________。
(3)在1 000 g水中需加入_____________________摩尔氯化钠,才能使其浓度恰好与上述混合溶液浓度相等。(保留1位小数)
答案 (1)20% (2)4.0 mol/L (3)4.3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com