
1.借助函数图像,直观地理解函数的最大值和最小值概念。
1.3.3函数的最大(小)值与导数
[学习目标]
19.氧化锌和锌的混合物14.6 g,加入浓度为1 mol/L的盐酸500 mL,充分反应后,所得溶液中Zn2+的物质的量浓度为0.4 mol/L,求原混合物中氧化锌和锌的物质的量。
答案 nZn=nZnO=0.1 mol


18.(12分)若配制500 mL 0.2 mol/L的稀硫酸:
(1)需要使用质量分数为0.98的硫酸(密度为1.84 g·mL-1)_____________mL。
(2)下面是某学生的操作过程:
a.检查容量瓶是否漏水;b.用100 mL的量筒量取浓硫酸;
c.将浓硫酸倒入另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温;
d.用玻璃棒引流,将稀释后的硫酸倒入500 mL的容量瓶;
e.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1 cm-2 cm;
f.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
g.在容量瓶上贴上标签待用。
按照通常的配制要求,指出其中缺少或操作的错误,并补充或改正(有几项填几项,若空格不够可以补加)。
①________________________________________________________;
②________________________________________________________;
③________________________________________________________;
④________________________________________________________;
⑤________________________________________________________。
(3)任何实验都有误差,在你改正后的操作中,产生误差的原因还有_________________________。
(4)本实验最浪费时间的步骤是将稀释后的硫酸冷却到室温,为了节约时间,简便易行的加快稀硫酸冷却的方法是_______________________________________________________。
答案 (1)5.4 (2)①缺少洗涤烧杯和玻璃棒的操作 ②量筒的规格错,应该用10 mL的量筒量取浓H2SO4(或
用移液管、酸式滴定管量取浓H2SO4)③不应该在量筒中稀释浓H2SO4,应用烧杯 ④不应该用容量瓶保存溶液,
应用细口瓶(3)量筒的精确度不够高(或读数误差,溶质仍有少量残留在烧杯内、室温未必是20℃等)
(4)充分搅拌(给盛有稀H2SO4的烧杯敷冰块等)
17.(6分)下图是医院病人输液时用的一瓶质量分数为5%的葡萄糖注射液标签,请认真观察标签处的所列内容后填写:
|
葡萄糖注射液 Glucose Injection 规格:250 mL内含葡萄糖12.5 g 生产批号:0203203 有效期:至2004年3月 配伍:5% 姓名: 床号: |

(1)该溶液中含水__________g。(2)该溶液的密度约为_____________g·mL-1。
(3)该溶液的物质的量浓度为___________________。
答案 (1)237.5 (2)1 (3)0.278 mol/L
16.(14分)(1)0.25 mol某固体A的质量是15 g,A的相对分子质量为__________________。
(2)在同温同压同体积的条件下,H2与气体A的质量之比是1∶8,则A的摩尔质量为_____________。
(3)在25℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量
为___________。
(4)两个同容积的密封容器A、B,在25℃下,A中充入a g A气体,B中充入a g CH4气体,A与B内的压强之比是4∶11,则A的摩尔质量为____________________。
(5)在同温同压下,相同体积的CH4与气体A的密度之比为1∶4,则A的摩尔质量为_______________。
(6)在标准状况下,气体A的密度是3.170 g/L,则A的摩尔质量为___________。
(7)在同温同压下,气体A对空气的密度是2,则A的摩尔质量为_______________。
答案 (1)60 (2)16 g/mol (3)30 g/mol (4)44 g/mol (5)64 g/mol (6)71 g/mol
(7)58 g/mol
15. (8分) (2009·扬州质检)化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10 mL A气体能分解生成15 mL O2和10 mL F2(同温同压)。
(8分) (2009·扬州质检)化合物A是一种不稳定的物质,它的分子组成可用OxFy表示。10 mL A气体能分解生成15 mL O2和10 mL F2(同温同压)。
(1)A的化学式是__________________________,推断的依据是___________________________。
(2)已知A分子中x个氧原子呈…O-O-O…链状排列,则A分子的电子式是_______________,结构式是____________________________。
答案 (1)O3F2 阿伏加德罗定律和元素质量守恒定律
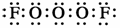 (2)?
F-O-O-O-F
(2)?
F-O-O-O-F
14.(2008·广州模拟)有一质量分数为12%的KCl溶液,当蒸发掉120 g水后,溶液的溶质质量分数增加一倍(仍未析出晶体),则原溶液中的溶质的质量为 ( )
A.14.4 g B.28.8 g
C.24 g D.12 g
答案 B
13.(2008·淄博统考)现有某温度下的KCl饱和溶液m1 g,溶质的质量分数为w1%,对其采取某种操作后析出m g无水KCl晶体,所得母液的质量为m2 g,溶质的质量分数为w2%,则下列关系正确的是 ( )
A.原条件下KCl的溶解度等于w1 g B.m1·w1%-m=m2·w2%
C.w1一定等于w2 D.m1- m 2≤m
答案 B
12.有五瓶溶液分别是:①10 mL 0.60 mol/L NaOH水溶液;②20 mL 0.50 mol/L硫酸溶液;③30 mL 0.40 mol/L HCl溶液;④40 mL 0.30 mol/L CH3COOH水溶液;⑤50 mL 0.20 mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是 ( )
A.①>②>③>④>⑤ B.②>①>③>④>⑤
C.②>③>④>①>⑤ D.⑤>④>③>②>①
答案 D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com