
20.(4分)为了更好的表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG = lg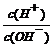 。25℃时,若溶液呈中性,则AG = ,溶液的pH与AG的换算公式为AG = (要简化)。
。25℃时,若溶液呈中性,则AG = ,溶液的pH与AG的换算公式为AG = (要简化)。
19.(8分)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,则该温度下水的Kw= 。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=12,b=2,则Va︰Vb= 。
(2)若所得混合液为中性,且a+b=12,则Va︰Vb= 。
(3)若所得混合液的pH=10,且a=12,b=2,则Va︰Vb= 。
18.(8分)已知:A酸的溶液pH=a,B碱的溶液pH=b
(1)若A为盐酸,B为氢氧化钡,且a+b=14,两者等体积混合,溶液的pH= 。酸碱按体积比为1:10混合后溶液显中性,则a+b= 。
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mo1·L–l,B溶液中水电离出的氢离子浓度为 mol·L–1。
(3)若A为醋酸,B为氢氧化钠,且a+b=14,用体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
17.(6分)限使用下列试剂:酚酞溶液、石蕊试液、稀氨水、氯化铵晶体、浓盐酸、熟石灰粉末、醋酸铵晶体和蒸馏水。根据:(i)弱碱在水中存在电离平衡;(ii)弱碱的阳离子会破坏水的电离平衡。这两种平衡移动均会引起指示剂颜色变化。由此可分别选用上述试剂,设计两个实验证明NH3·H2O是弱碱。请简述实验方法及现象。
(1)应用根据(i)的实验方法及现象:________________________________________
_____________________________________________________________________
____________________________________________________________________。
(2)应用根据(ii)的实验方法及现象:_______________________________________
_____________________________________________________________________
____________________________________________________________________。
16.(6分)有一学生在实验室测某溶液pH。实验时,他先用蒸馏水润湿pH试纸,然后用洁净干燥的玻璃棒蘸取试样进行检测。
(1)该学生的操作是 (填“正确的”或“错误的”),理由是
。
(2)该学生的检测结果是否一定存在误差?原因是
。
(3)若按此法分别测定c(H+)相等的盐酸和醋酸溶液的pH,误差较大的是 ,原因是
。
15.常温下,等体积的下列各组酸和碱的溶液混和后,溶液 pH<7的是
①pH之和为14的硝酸和氢氧化钾溶液; ②pH之和为15的盐酸和氨水溶液;
③pH之和为14的醋酸和苛性钠溶液; ④pH之和为13的硫酸和氢氧化钡溶液
A.② B.①② C.②③ D.③④
14.室温时,下列混合溶液的pH一定小于7的是
A.pH = 3的盐酸和pH = 11的氨水等体积混合
B.pH = 3的硫酸和pH = 11的氨水等体积混合
C.pH = 3的盐酸和pH = 11的氢氧化钡溶液等体积混合
D.pH = 3的醋酸和pH = 11的氢氧化钡溶液等体积混合
13.在一定体积pH =1的HCl与HNO3的混合溶液中,逐滴加入c mol·L-1的AgNO3溶液,当溶液中的Cl-恰好完全沉淀时,溶液pH =2。若反应后溶液的体积等于反应前两溶液体积之和,则原溶液中NO3-的物质的量浓度(mol·L-1)是
A.0.1c B.9c C.0.1–9c D.0.1–0.9c
12.pH=5的H2SO4溶液稀释500倍后,溶液中c(H+):c(SO42-)约为
A.1:2 B.1:5 C.1:10 D.10:1
11.常温下,物质的量浓度均为0.1mol·L-1的两溶液HA、BOH。其中HA溶液的pH > 1,BOH溶液中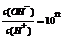 ,则下列有关说法正确的是
,则下列有关说法正确的是
A.HA溶液中水的电离程度大于BOH溶液中水的电离程度
B.将HA、BOH溶液稀释相同的倍数,pH值变化前者大于后者
C.若两溶液混合时:V(BOH) ≥ V(HA) ,则混合液中必有c(B+)>c(A-)
D.将HA、BOH混合所得pH=7的溶液中必有c(B+)=c(HA)+c(A- )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com