
1.由晶体结构来确定.首先分析物质所属的晶体类型,其次抓住决定同一类晶体熔、沸点高低的决定因素.
①一般规律:原子晶体>离子晶体>分子晶体
如:Si02>NaCl>CO2(干冰),但也有特殊,如熔点:MgO>SiO2
②同属原子晶体,一般键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.
如:金属石>金刚砂>晶体硅 原因 rC-C<rC-Si <rSi-si
③同类型的离子晶体,离子电荷数越大,阴、阳离子核间距越小,则离子键越牢固,晶体的熔、沸点一般越高.如:MgO>NaCl
④分子晶体,分子间范德华力越强,熔、沸点越高.
分子组成和结构相似的分子晶体,一般分子量越大,分子间作用力越强,晶体熔、沸点越高.
如:F2<Cl2<Br2<I2
ii 若分子量相同,如互为同分异构体,则支链数越多,沸点越高,分子越对称,则熔点越高.
如:沸点: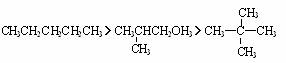
熔点: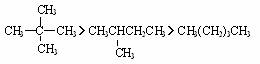
因而应注意,并非外界条件对物质熔、沸点的影响总是一致的.熔点常与晶体中微粒排布对称性有关.
iii 若分子间有氢键,则分子间作用力比结构相似的同类晶体强,故熔、沸点特别高.
如:氢化物的沸点如下图所示.
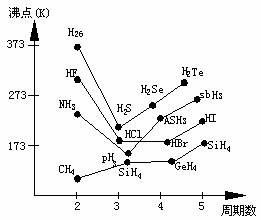
从上图中看出,H2Te、H2Se、H2S的沸点都依次降低.按此变化趋势.H2O的沸点应为193K左右,但实际上为373K、此种“反常”的升高,就是因为H2O分子间存在氢键。对比同主族氢化物的沸点,从中可清楚看到NH3、HF的沸点高得“反常”,也是因为分子间存在氢键。
HF分子间氢键: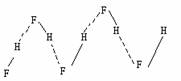
H2O分子间氢键: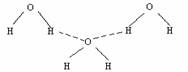
氢键的生成对化合物性质有显著影响,一般分子间形成氢键时,可使化合物的熔、沸点显著升高,在极性溶剂中,若溶质分子和溶剂分子间形成氢键,则可使熔解度增大.如NH3极易溶于水就与此有关.除上述几种物质外,在醇、羧酸、无机酸、水合物、氨合物等中均有氢键.
⑤金属晶体:金属原子的价电子数越多,原子半径越小、金属键越强,熔、沸点越高.
如:Na<Mg<Al
晶体的类型直接决定着晶体的物理性质,如熔、沸点、硬度、导电性、延展性、水溶性等。而晶体的类型本质上又是由构成晶体的微粒及微粒间作用力决定,通常可以由晶体的特征性质来判定晶体所属类型。掌握下表内容是重点之一。对一些常见物质,要会判断其晶体类型。
比较四种晶体类型

4.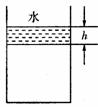 江苏省南师大附属扬子中学2010届高三周练实验室内,某同学用导热性能良好的气缸和活塞将一定质量的理想气体密封在气缸内(活塞与气缸壁之间无摩擦),活塞的质量为m,气缸内部的横截面积为S.用滴管将水缓慢滴注在活塞上,最终水层的高度为h,如图所示.在此过程中,若大气压强恒为p0,室内的温度不变,水的密度为
江苏省南师大附属扬子中学2010届高三周练实验室内,某同学用导热性能良好的气缸和活塞将一定质量的理想气体密封在气缸内(活塞与气缸壁之间无摩擦),活塞的质量为m,气缸内部的横截面积为S.用滴管将水缓慢滴注在活塞上,最终水层的高度为h,如图所示.在此过程中,若大气压强恒为p0,室内的温度不变,水的密度为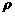 ,重力加速度为g,则:
,重力加速度为g,则:
①图示状态气缸内气体的压强为 ;
②以下图象中能反映密闭气体状态变化过程的是 .
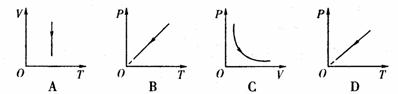
答案:①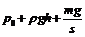 ②A
②A
3.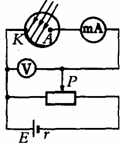 江苏省淮阴中学2010届高三摸底考试如图所示的实验电路,当用黄光照射光电管中的碱金属涂层时,毫安表的指针发生了偏转.若将电路中的滑动变阻器的滑片P向右移动到某一位置时,毫安表的读数恰好减小到零,此时电压表读数为U。若此时增加黄光照射的强度,则毫安表
▲ (选填“有”或“无”)示数.若改用蓝光照射光电管中的金属涂层,则毫安表
▲ (选填“有”或“无”)示数。
江苏省淮阴中学2010届高三摸底考试如图所示的实验电路,当用黄光照射光电管中的碱金属涂层时,毫安表的指针发生了偏转.若将电路中的滑动变阻器的滑片P向右移动到某一位置时,毫安表的读数恰好减小到零,此时电压表读数为U。若此时增加黄光照射的强度,则毫安表
▲ (选填“有”或“无”)示数.若改用蓝光照射光电管中的金属涂层,则毫安表
▲ (选填“有”或“无”)示数。
答案:无;有
2. 贵州省兴义市清华实验学校2010届高三9月月考一同学在“用双缝干涉测光的波长"实验中,使用的双缝的间距为0.02 cm,测得双缝与屏的距离为50 cm,第1级亮纹中心到第5级亮纹中心的距离为0.4 5 cm,则待测单色光的波长是 .
答案:4.5×10-7m
1. 河南省新郑州二中分校2010届高三第一次模拟利用油膜法估测油酸分子的大小,实验器材有:浓度为0.05 %(体积分数)的油酸酒精溶液、最小刻度为0.1 mL的量筒、盛有适量清水的45×50 cm2浅盘、痱子粉、橡皮头滴管、玻璃板、彩笔、坐标纸
下面是实验步骤:
A.用滴管将浓度为0.05 %的油酸酒精溶液一滴一滴地滴入量筒中,记下滴入1 mL油酸酒精溶液时的滴数N
B.将痱子粉均匀地撒在浅盘内水面上,用滴管吸取浓度为0.05%的油酸酒精溶液,从低处向水面中央一滴一滴地滴入,直到油酸薄膜有足够大的面积又不与器壁接触为止,记下滴入的滴数n
C. 将玻璃板放在浅盘上,用彩笔将油酸薄膜的形状画在玻璃板上
D.将画有油酸薄膜轮廓的玻璃板放在坐标纸上,以坐标纸上边长为1 cm的正方形为单位,计算轮廓内正方形的个数,算出油酸薄膜的面积S cm2
用已给的和测得的物理量表示单个油酸分子的大小_____________(单位:cm)
答案: 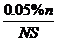 (6分)
(6分)
29、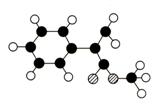 (16分)A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图,所示(图中球与球之间连线代表化学键单键或双键)。
(16分)A是生产某新型工程塑料的基础原料之一,分子式为C10H10O2,其分子结构模型如图,所示(图中球与球之间连线代表化学键单键或双键)。
(1)根据分子结构模型写出A的结构简式 ___________
(2)拟从芳香烃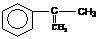 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下:
已知:A在酸性条件下水解生成有机物B和甲醇。
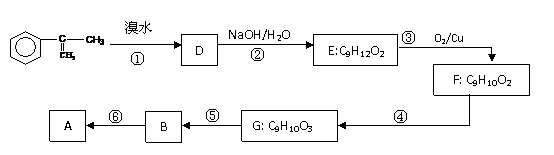
(a)写出⑤反应类型__________ ;F中含氧官能团的名称为
(b)写出G的结构简式 ___________
(c) 写出反应方程式(注明必要的条件)
③ __________________________________________________________
⑥ ________________________________________________________
28、(15分)某探究小组的同学设计实验探究铁与水蒸气的反应,并探究反应后生成物的一系列性质。
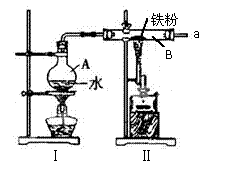
(1)写出B中发生反应的化学方程式: 。
(2)图I、II均有加热装置,实验时,应先点_____(填“I”、“II”或“无先后”)处加热装置,目的是防止_____________。
(3)为防止加热时A中水爆沸,应在A中加入几片 。
(4)为证硬质玻璃管B中反应后的气体产物是H2,还需从下图中选择必要的仪器和药品,设计出一套装置。
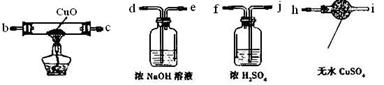
Ⅲ Ⅳ Ⅴ Ⅵ
①按你所设计装置,连接顺序为:a连____,____连____,____连____。(填接口字母)
②连接好你设计的装置图后,理论上,从实验安全角度考虑出发,在点燃CuO处酒精灯之前,应该先 ?简答如何进行此操作 。
③证明产物有氢气的实验现象是: 。
27、(13分)A-J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
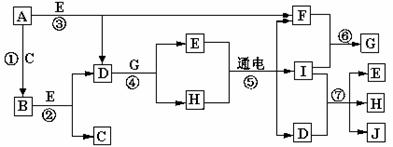
回答下列问题:
(1) B的化学式: 。
(2)写出反应⑦的离子方程式 __________________________。
(3)J的溶液显 性,用离子方程式表示其原因_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_______(填“阴、阳”)极附近溶液由无色变为红色,请用适当化学用语表达其原因_________________ 。
26、(16分)
(1)混合动力汽车因具有能量利用率高(95%以上)、节省汽油、发动机噪音低和几乎没有尾气污染等优良性能,受到越来越多的关注,某种混合动力汽车的动力系统由“1.3L汽油机+5速手动变速器+10kW电机+144V镍氢电池”组成。
①汽油机的燃料之一是乙醇,1g乙醇完全燃烧恢复至常温时放出29.7kJ热量,写出乙醇燃烧的热化学方程式___________________________________。
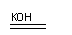 ②镍氢电泄的使用可减少重金属离子污染,它采用储氢金属作为负极,碱液(主要是KOH溶液)作为电解液,镍氢电池充电时发生反应:Ni(OH)2 NiO(OH)+1/2H2。
②镍氢电泄的使用可减少重金属离子污染,它采用储氢金属作为负极,碱液(主要是KOH溶液)作为电解液,镍氢电池充电时发生反应:Ni(OH)2 NiO(OH)+1/2H2。
其放电时正极电极反应式为____________________________,负极附近溶液的pH____(填“增大”、“减小”或“不变”)
(2)已知一定温度和压强下,在容积为VL的密闭容器中充入1mol A和1mol B,保持恒温恒压下反应:A(g) + B(g)  C(g) ;△H<0。达到平衡时,C的体积分数为40% 。试回答有关问题:
C(g) ;△H<0。达到平衡时,C的体积分数为40% 。试回答有关问题:
①升温时,C的消耗速率_______(填“增大”、“减小”或“不变”),平衡向________(填“左”、“右”或“不”)移动,达平衡后C的体积分数______40%(填“大于”、“小于”或“不知道”)。
②若使温度、压强在上述条件下恒定不变,改向密闭容器中充入2mol A和2 mol B,则反应达到平衡时,C的体积分数为_______;达平衡时容器的容积为_______ L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com