
4.已知氯化铝的熔点为190OC(2.02×105Pa),但它在180OC即开始升华.
(1)氯化铝是_________(填“离子化合物”或“共价化合物”).
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g/L,且已知它的结构中还含有配位键,氯化铝的化学式为________,结构式为_________.
(3)无水氯化铝在潮湿空气中强烈地“发烟”,其原因是_________.
(4)如何通过实验来判别氯化铝是离子化合物还是共价化合物?
例4.某离子晶体部分结构如图
(1)晶体中每个Y同时吸引着最近的________个X,每个X同时吸引着最近的________个Y,该晶体的化学式为________
(2)晶体中每个X周围与它最近且距离相等的X共有________个.
(3)晶体中距离最近的2个X与一个Y形成的夹角∠XYX的角度________
(4)设该晶体的摩尔质量为Mg·cm-3 ,晶体密度为ρg·cm-3,阿佛加法罗常数为NA,则晶体中两个距离最近的X中心间距离为_____cm-
,晶体密度为ρg·cm-3,阿佛加法罗常数为NA,则晶体中两个距离最近的X中心间距离为_____cm-

3.1995年美国Lagow教授报道,他制得了碳的第四种同素异性体一链式炔碳…-C≡C-C≡C-C≡C-…该物质的一个分子中含有300~500个碳原子,性质很活泼。据此判断,链式炔碳的熔点估计比石墨________
2.分析下列物质的物理性质,判断其晶体类型:
A.碳化铝,黄色晶体,熔点2200OC,熔融态不导电____________
B.溴化铝,无色晶体,熔点98OC,熔融态不导电____________
C.五氟化钒,无色晶体,熔点19.5OC,易溶于乙醇、氯仿、丙酮中____________
D.溴化钾,无色晶体,熔融时或溶于水中都能导电____________
1、2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮, 这种高聚氮的N-N键的键能为160 kJ/mol (N2的键能为942 kJ/mol),晶体结构如图所示。在这种晶体中,每个氮原子与其它三个氮原子相连;按键型分类时,属于 晶体。这种固体的可能潜在应用是 ,这是因为: 。
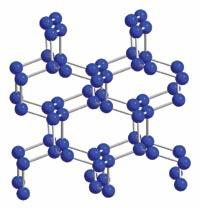
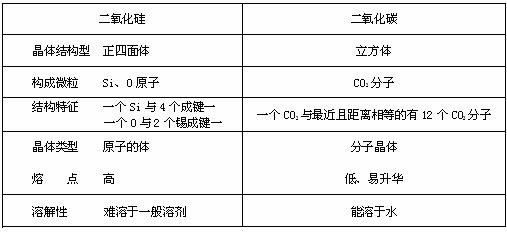
3.二氧化硅和二氧化碳晶体
典型高考试题解析
例1.(2007海南·22)下列叙述正确的是( )
A.分子晶体中的每个分子内一定含有共价键
B.原子晶体中的相邻原子间只存在非极性共价键
C.离子晶体中可能含有共价键
D.金属晶体的熔点和沸点都很高
解析:本题中稀有气体为单原子分子无共价键;原子晶体中如SiO2 也存在Si-O极性共价键,B错;在铵盐中既存在离子键又存在共价键,C正确。金属汞的熔点很低,D错。答案:C 。
例2.(2007海南·24)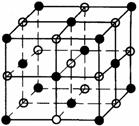 NaCl的晶胞如右图,每个NaCl晶胞中含有的Na+离子和Cl
NaCl的晶胞如右图,每个NaCl晶胞中含有的Na+离子和Cl 离子的数目分别是( )
离子的数目分别是( )
A.14,13 B.1,1 C.4,4 D.6,6
解析:每个NaCl晶胞中含有的Na+离子和Cl 离子的数目分别是4、4。答案:C 。
离子的数目分别是4、4。答案:C 。
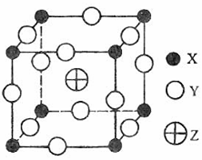 例3.(08年海南化学·24)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的
例3.(08年海南化学·24)已知X、Y、Z三种元素组成的化合物是离子晶体,其晶胞如图所示,则下面表示该化合物的化学式正确的
A.ZXY3 B.ZX2Y6
C.ZX4Y8 D.ZX8Y12
解析:化合物的化学式确定的方法为均摊法。X处在正方体的八个顶点上,其个数为: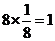 ;Y处在正方体的12条楞上,其个数为:
;Y处在正方体的12条楞上,其个数为: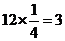 ;Z处在正方体的体心上,其个数为1。答案:A。
;Z处在正方体的体心上,其个数为1。答案:A。
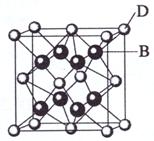 例4.(09年海南化学·19.4)(11分)
例4.(09年海南化学·19.4)(11分)
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图。
请回答:
(1)A元素的名称是 ;
(2)B的元素符号是 ,C的元素符号是 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(3)E属元素周期表中第 周期,第 族的元素,其元素名称是 ,它的+2价离子的电子排布式为 :
(4)从图中可以看出,D跟B形成的离子化合物的化学式为 ;该离子化合物晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出算式)。
解析:从D、E是周期表中1-18列中E排第7列可判断E是第4周期VIIB族,所以D也在第4周期;图中离子化合物D:B=1:2,则D为Ca,且B的序数在前面,B为F,C为Cl;A与其他4种元素既不在同一周期又不在同一主族,所以A为H。
(2)考查氢键;(3)锰在周期表中的位置,+2价时已经失去个电子,所以排布式为[Ar]3d5;
(4)ρ= 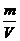 = (40+38)×4÷(6.02×1023)g÷V = a g·cm-3
= (40+38)×4÷(6.02×1023)g÷V = a g·cm-3
V = 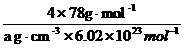
答案::(11分)
(1)氢(1分)
(2)F Cl 氟化氢分子间存在氢键,氯化氢分子间没有氢键(3分)
(3)四 VIIB 锰 1s22s22p63s23p63d5(4分)
(4)CaF2
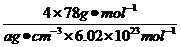 (3分)
(3分)
专题训练
3.金刚石和石墨的比较
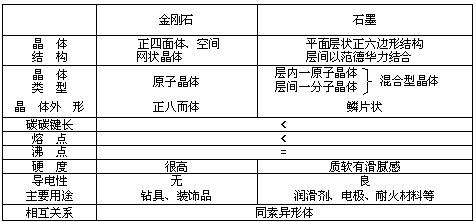
注意:①石墨有导电性,是因为层内有自由电子.②碳还有多种因素异形体,如足球碳C60等.
想一想:C60、N60等属于什么晶体?可能是原子晶体吗?
2、晶胞中微粒个数的计算
构成晶体的结构粒子是按着一定的排列方式所形成的固态群体。在晶体结构中具有代表性的最小重复单位叫晶胞。
位于晶胞顶点的微粒,实际提供给晶胞的只有1/8;
位于晶胞棱边的微粒,实际提供给晶胞的只有1/4;
位于晶胞面心的微粒,实际提供给晶胞的只有1/2;
位于晶胞中心的微粒,实际提供给晶胞的只有1。
1.离子晶体 CsCl NaCl
离子配位数 8:8 6:6
一个晶胞中含 1,1 4,4
阳离子和阴离子数
晶胞构型 立方体 立方体
重点掌握NaCl晶体结构,它还具有的特征:
①一个Na+周围等距且最近的Cl-有6个,此6个Cl-连线形成的空间几何体为正八而体,Na+位于其中心.
②一个Na+周围等距且最近的Na+有12个
如何计算离子晶体中不同部位的离子对晶胞的贡献?
体心(内) 面心 棱上 角顶
系统数
1

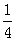
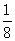
计算NaCl晶体微粒数:
Na+: 体心(1个) 棱(各1个)
1+12×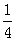 =4
=4
Cl- 面心(各1个) 角顶(各1个)  ×6 +
×6 + 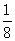 ×8=4
×8=4
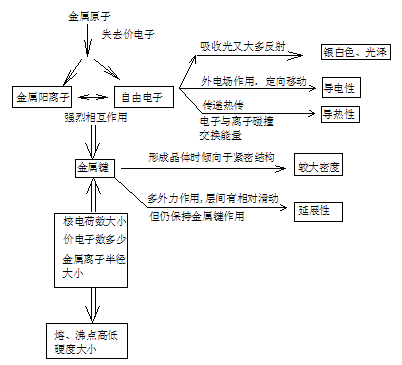
注意:温度升高对金属、电解压溶液导电性影响是不同的.
在金属晶体中原子或离子不是静止不动,而在晶格结点上作较小幅度振动,这种振动对电子流动起着阻碍作用,加上阳离子对电子的吸引,电子运动便受到更多阻力,因而升温,金属电阻加大,导电能力下降.
在电解压溶液中,导电微粒是自由移动离子,升温有利于加快运动,导电性增强.
2.根据物质在同条件下的状态不同.
一般熔、沸点:固>液>气.
如果常温下即为气态或液态的物质,其晶体应属分子晶体(Hg除外).如惰性气体,虽然构成物质的微粒为原子,但应看作为单原子分子.因为相互间的作用力范德华力,而并非共价键.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com