
4、解析:(1)从氯化铝的熔点低且易升华的性质可判定其晶体为分子晶体,也就不可能属于离子化合物。同学不能简单地从组成元素为较活泼金属元素和活泼非金属元素考虑,将其为离子化合物,其实不然,应尊重事实。可根据其熔融态能否导电进行判断。切勿用它的水溶液做导电性实验。因为象HCl等许多共价化合物在水分子作用下能电离,故所得水溶液能导电。
(2)应根据M=22.2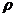 关系式求出蒸气的分子量,与常见的AlCl3分子量比较是否相同,从而确定氯化铝的化学式,要注意配位键的表示方式.“→”是从具有孤对电子的一方指向具有空道的原子,在此只可能C1→A1,每一个C1还与A1原子形成一个共价键.
关系式求出蒸气的分子量,与常见的AlCl3分子量比较是否相同,从而确定氯化铝的化学式,要注意配位键的表示方式.“→”是从具有孤对电子的一方指向具有空道的原子,在此只可能C1→A1,每一个C1还与A1原子形成一个共价键.
(3)抓住题中条件“在潮湿空气中发烟”应从AlCl3水铜生成HCl与水蒸气形成酸雾,不能误认AlCl3为升华成气体。
3、解析:不要被“含有300~500个碳原子”所迷惑、而应抓住该物质的组成微粒“分子”,从而可判定链式炔碳属分子晶体,显烙点然比石墨低得多.
2、解析:晶体的熔点高低,熔融态能否异电及溶剂性相结合,是判断晶体类型的重要依据。原子晶体和离子晶体的熔点都很高或较高,两者最大的差异是熔融态的异电性不同。原子晶体熔融不导电,离子晶体熔融时或水溶液都能导电。原子晶体和分子晶体的区别则主要在于熔、沸点有很大差异。一般原子晶体和分子晶体熔融态时都不能导电。另外易溶于一些有机溶剂的物质往往也是分子晶体的特征之一。
1、点拨:本题需通过组成该晶体的微粒及微粒间的相互作用力来判断晶体的类型,以及进一步探讨该晶体的用途。
答案:原子 炸药(或高能材料) 高聚氮分解成N2释放大量能量
10、图中NaCl晶体结构向三维空间延伸得到完美晶体。最近的Na+与Cl-核间距离为a×10-8cm,求晶体密度?
答案详解:
9、研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中钠离子跟离它的最近的氯离子之间的距离为d,以钠离子为中心,则:
(1)第二层离子有_____________个,离中心离子的距离为_________d,它们是________离子。
(2)已知在晶体中钠离子的半径为116pm,氯离子的半径为167pm,它们在晶体中是紧密接触的。求离子占据整个晶体空间的百分数。
(3)纳米材料的表面原子占总原子数的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
(4)假设某氯化钠颗粒形状为六立方体,边长为氯化钠晶胞边长的10倍,试估算表面原子占总原子数的百分比。
8、.(09年广东化学·27)(10分)
 铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第I B族。Cu2+的核外电子排布式为 。
(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
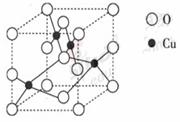
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4 H2O,其结构示意图如下:
下列说法正确的是 (填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH2)2]2+配离子。已知NF3与NH3的空间构型都是三角锥形,单NF3不易与Cu2+形成配离子,其原因是 。
(5)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
7.(8分)(08年山东理综·32)[化学--物质结构与性质]
氮是地球上极为丰富的元素。
(1)Li3N晶体中氮以N3-存在,基态N3-的电子排布式为___________。
(2) N
 N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。
N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,计算说明N2中的___________键比____________键稳定(填“σ”或“π”)。
(3)(CH3)3NH+和AlCl4-可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂__________(填“大”或“小”),可用作__________(填代号)。
a.助燃剂
 b.“绿色”溶剂
b.“绿色”溶剂
c.复合材料
d.绝热材料
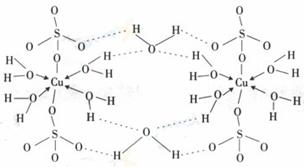
(4)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是_____________,与同一个N3-相连的X+有__________个。
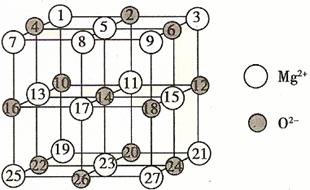
6.(10分)(08年广东化学·27)镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如下图所示,请改正图中错误: 。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
|
氧化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因: 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合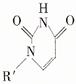 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:
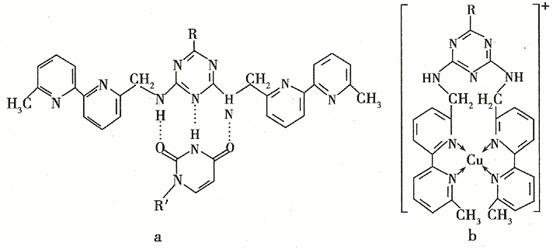
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异 。
5.(07年山东理综·32)(8分)[化学-物质结构与性质]
请完成下列各题:
(1)前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)第ⅢA、ⅤA原元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似。Ga原子的电子排布式为 。在GaN晶体中,每个Ga原子与 个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为 。在四大晶体类型中,GaN属于 晶体。
(3)在极性分子NCl3中,N原子的化合物为―3,Cl原子的化合价为+1,请推测NCl3水解的主要产物是 (填化学式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com