
2、排重项。两选项的观点定位不在题干的规定范围,两选项的观点与题干规定范围的要求是变相重复的,应排除。
1、排错项。选项的观点本身错误或包含着部分错误的要排除。
2、对简答题的审题,第一步审材料:看完所有文字、表格或图材料,文字要画出关键词,进行材料概念引申,挖掘图表中直接和暗含的条件,包括图例、注记、数字、线条、方向、经纬度、关键地点等,分析材料含义和用意,可能用在什么地方,然后将所有能用的条件归纳,准备用。第二步审问题:设问一般包括"是什么""为什么""怎么样"。通过题目中的问题,调动自己的知识储备,联系平时所学的地理概念、原理,形成答题框架系统。如分析某地的农业区位因素,需要用到地形、气候、土壤、水源等自然条件和交通、市场、政策等社会经济条件。第三步审材料与问题的内在联系,找到突破口,用自己形成的答题框架系统,进行逐项表达。
1、对选择题的审题的"三审",即一审材料(加以引申)、二审题干(画出关键词)、三审选项(找出合理、正确并与材料和题干有关的选项)。
解答地理试题,首先是要深刻理解"地理"这两个字的本质含义,最重要的也是最关键的是"知地明理",注重由"地"联想到"理"的解题方法。善于将地理试题情境回归到基本地理概念、基本原理和规律上。"地"就是"地方",就是"地理位置",就是"地理范围"。"理"就是"道理",就是"原理",就是"理由"。"知地"就是准确定位,弄清是哪里,在什么地方,属于什么地理知识范筹。"明理"就是在"知地"的前提下,明确"这个地方的地理特征",明确"这个地方的相关地理知识原理",明确解答"这个地理内容"的"理"究竟在什么地方,弄清楚"这个知识范围"要求运用的知识原理。通常采用经纬网定位法、自然人文特征定位法、特征地理事物定位法、特殊注记定位法等方法,快速进行图文、文图和图图转化,准确空间定位,确定考查的知识点,然后按基本原理和规律一一解答。
一个心理定位就是考生给自己定位。即使是平时成绩优秀的考生也"宜低不宜高",在平时可以下比较高的分数目标,现在高考了,就不宜下高指标,甚至下比平时较低的指标。例如满分是100分,你的地理成绩比较好,最多也定位在80分,这样一来,当你一开始做前面的选择题时,一旦遇到一两道难题即使做不了,也觉得是正常的,也不会造成心里紧张。因为这时感觉到可能要丢掉几分是你的"预料"之中, 以此达到减轻心里压力的目的。
7、解析:基态N3-的电子10个,已达稳定状态,故为1s22s22p6,计算可知,N≡N中的π键的键能为942 kJ·mol-1减去N-N单键的键能247 kJ·mol-1 ,因此π键比σ键稳定。离子液体由阴、阳离子组成,其挥发性较小,且无污染。X+中所有电子正好充满KLM三个电子层,应含有28个电子,则X原子未29个电子,X的元素符号是Cu,X+ 和N3-组成比例为3:1,根据晶体结构图所示黑点为X+,白点为N3-,与同一个N3-相连的X+有6个。
6、解析:(1) 以MgCl2为原料用熔融盐电解法制备Mg时,常加入NaCl、KCl、或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有:增大离子浓度,从而增大熔融盐的导电性。
(2) 请更正图中错误:⑧应为黑色。
(3) 请用原子结构的知识解释发光的原因:原子核外电子按一定轨道顺序排列,轨道离核越远,能量越高。燃烧时,电子获得能量,从内侧轨道跃迁到外侧的另一条轨道。跃迁到新轨道的电子处在一种不稳定的状态,它随即就会跳回原来轨道,并向外界释放能量(光能)。
(4) 解释表中氟化物熔点差异的原因:NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高。又因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF。
(5) ①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有:σ键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用的差异:a中微粒间的相互作用为氢键,b中微粒间的相互作用为配位共价键。
答案:(10分)(物质结构选做题)
(1)增大离子浓度,从而增大熔融盐的导电性
(2)⑧应为黑色
(3)原子核外电子按一定轨道顺序排列,轨道离核越远,能量越高。燃烧时,电子获得能量,从能量较低的轨道跃迁到能量较高的另一条轨道。跃迁到新轨道的电子处在一种不稳定的状态,它随即就会跳回原来的地能量轨道,并向外界释放能量(光能)
(4)NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高。又因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF。
(5)①σ键 ②a中存在氢键和范德华力,b中存在配位键
5、
解析:(1)第四周期中,基态原子中未成对电子数与其周期数相同的元素包括:第1周期的氢、第二周期的碳和氧、第三周期的磷、第四周期的铁,共5种。
(2)Ga在元素周期表中是第四周期、第ⅢA族,原子序数是31,即其原子核外电子数是31,根据核外电子的排布规律可以写出该原子的电子排布式为:1s22s22p63s23p63d104s24p1或[Ar]3d104s24p1。因为GaN晶体结构与单晶硅相似,可知GaN晶体是原子晶体,晶体结构为空间网状结构,每个Ga原子与四个N相连,这四个N原子构成的空间构型是正四面体型。
(3)水解反应前后各元素的化合价不变,由题意知NCl3中N的化合价为-3价,Cl的化合价为+1价,则在NCl3水解的产物中N的化合价也是-3价,Cl的化合价是+1价,分析可知其水解产物是HClO和NH3 ·H2O 。
答案:(1)5
(2)1s22s22p63s23p63d104s24p1(或[Ar]3d104s24p1) 4 正四面体 原子
(3)HClO NH3·H2O
5、解析:(1)从图中可知,Y位于立方体中心,X位于立方体相向的四个项点,故一个Y同时吸引着最近的X有4个,每个X同时吸引着最近的8个Y,由此确定其化学式.
(2)由于顶点X是8个立方体共有,每个面是两个立方体共享,故晶体中每个X周围与它最近且距离相等的X应有8×3× =12(个)
=12(个)
(3)可将图中4个X分别与Y连线,形成的构型类同于CH4分子,∠XYX=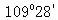

(4)每个小方体中会XY2的物质的量为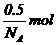 .
.
根据质量m=ρV 和 m=nM
联立方程,求解。
答案:(1)4;8;XY2(或Y2X)。(2)12。(3)109°28'。(4)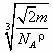 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com