
新课程标准和新考纲都强调考生在对文学作品的学习、鉴赏中,除了具有积极的鉴赏态度,注重陶冶性情、涵养心灵外,还要能领悟作品的本质、内涵,体会其艺术表现力,尤其要从人物形象、时代背景、环境氛围、细节描写、语言表达等方面入手,努力探索作品中蕴含的民族心理和人文精神,了解人类丰富的社会生活和情感世界。比如2008年江苏卷对汪曾祺小说《侯银匠》的考查,设计的探究题是:
15.小说题为“侯银匠”,但写侯菊的文字多,请结合全文探究作者这样安排的理由。
《侯银匠》一文写普通人一生中最重大的事,从中折射出人性之美。小说的首尾部分值得关注,开头写“侯银匠店特别处是附带出租花轿。银匠店出租花轿,不知是什么道理”,下文虽未直接回答“是什么道理”,但仔细玩味,应该是指侯银匠作为手艺人,勤劳且机灵;倒数第三段回到侯银匠身上,写他无妻而女儿又不在身边,于是对女儿十分思念,最后一段写他喝酒,想起两句唐诗--姑苏城外寒山寺,夜半钟声到客船,进一步写出他对女儿的深切思念,这就把侯银匠这一形象塑造得富有人情美、人性美。由此,可明确小说的主旨是表现侯银匠,而写侯菊的文字多(或者说“更多描写女儿出嫁前后的情景”),在人物关系中深刻表现了中国传统的人情美、人性美,读来意味深长。
当然,本题也可从人物关系(侯菊继承了父亲的精细、勤劳等品质,写侯菊就是表现侯银匠)、情节设计(女儿出嫁是他生活中的大事,更多描写此时此刻的情景,重点突出,可以避免平铺直叙)、思想内容(截取侯菊出嫁前后的片段,正面描写侯菊,间接烘托出侯银匠的人生况味)、写作技法(实写侯菊,暗写侯银匠,以有形写无形,更有情趣)等角度组织答案。
22.(福建08-09学年福州三中高三理科综合试卷)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
(1)该反应的离子方程式为(提示:H2C2O4的一级电离常数为5.4×10-2)
__________________________________________________________________。
(2)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol·L-1)的用量均为2mL。如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
(3)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
|
KMnO4酸性溶液 的浓度 / mol·L-1 |
溶液褪色所需时间 t
/ min |
||
|
第1次 |
第2次 |
第3次 |
|
|
0.01 |
14 |
13 |
11 |
|
0.001 |
6 |
 7 7 |
7 |
①
计算用0.001 mol·L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化,写出计算过程)
② 若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?____________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:_________________________________________________________
21. (福建厦门双十中学09届高三第二学期开学考)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:
(福建厦门双十中学09届高三第二学期开学考)某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:


 请根据上面流程,回答以下问题:
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)操作II必须用到的仪器是 。(填编号)
A.50mL烧杯 B.50mL量筒 C.100mL量筒 D.25mL滴定管
(2)请写出加入溴水发生的离子反应方程式 ,加入氨水要过量的原因是 。
(3)洗涤沉淀的操作是 ;检验沉淀是否已经洗涤干净的操作是 。
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3g,则接下来还应进行的操作是 。
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是 (列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是 。
20.(漳州市芗城中学2009年5月份月模拟)
Ⅰ.短周期元素X、Y、Z、W在元素周期表中的位置如右图所示,其中X、Y、Z三种元素的质子数之和为21。
(1)氢元素与Z形成原子个数比为1∶1的化合物,其结构式为 。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是 (用离子方程式表示) ;该溶液中各种离子浓度由大到小的顺序为 。
(3)写出Y的最高价氧化物对应水化物的浓溶液与X在加热条件下反应的化学方程式
,反应中每转移8mol 电子,消耗的还原剂质量为 g
Ⅱ.为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:2CO(g)+O2(g)===2CO2(g);ΔH=-566kJ·moL-1
2H2(g)+O2(g)===2H2O(g);ΔH=-483.6KJ·moL-1
H2O (g)===H2O(l);ΔH=-44.0KJ·moL-1
写出CO和H2O(g)作用生成CO2和H2的热化学方程式 。Ⅲ.H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是 。
19.(2008广东佛山二模)生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇是比较常见的有机物。
(1)乙醇是无色有特殊香味的液体,密度比水_________
(2)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为________________ (不用写反应条件),原子利用率是_________ 。
(3)乙醇能够发生氧化反应:
① 46 g乙醇完全燃烧消耗__________mol氧气。
②乙醇在铜做催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为
________ _ __。
③下列说法正确的是__________。(选填字母)
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.交警用橙色的酸性重铬酸钾溶液检查司机是否酒后驾车
 C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
D.陈年的酒很香是因为乙醇和乙醇被氧化生成的乙酸发生酯化反应生成了乙酸乙酯
18. (福建漳州双语实验学校09年高考理科综合模拟试卷三)火力发电厂燃煤排烟,释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体。这些气体直接排放到空气中,将造成环境污染。为解决排烟污染问题,某发电厂采用如下措施,对燃煤烟气进行脱硝、脱硫和脱碳等处理,实现绿色环保、节能减排、废物利用等目的
(福建漳州双语实验学校09年高考理科综合模拟试卷三)火力发电厂燃煤排烟,释放出大量的氮氧化物(NOx)、二氧化硫和二氧化碳等气体。这些气体直接排放到空气中,将造成环境污染。为解决排烟污染问题,某发电厂采用如下措施,对燃煤烟气进行脱硝、脱硫和脱碳等处理,实现绿色环保、节能减排、废物利用等目的
(1)脱硝。利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H= -574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H= -1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:______________________________
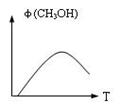 (2)右图表示某次合成实验中甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线,则上述二氧化碳转化为甲醇反应的△H 0(填
>、 =、或
<)。
(2)右图表示某次合成实验中甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线,则上述二氧化碳转化为甲醇反应的△H 0(填
>、 =、或
<)。
(3)脱硫。用碳酸钙作吸收剂与水配制成浆液,在吸收塔中洗涤烟气并吸收SO2,得到石膏(CaSO4·2H2O)
电厂第一季度用煤300t(煤中含有硫2.8%),若燃烧时煤中的硫全部转化成二氧化硫,且吸收脱硫过程中80%的硫转化为转化为石膏,则第一季度可生产石膏___________吨。
(4)最新处理技术是用纳米型氧缺位铁酸盐(MFe2OX 3<x<4,M=Mn、Co等金属)来处理燃煤排烟。常温条件下,纳米型氧缺位铁酸盐能使烟气中的酸性氧化物转化为单质,自身被氧化为MFe2O4。已知:93.2g纳米型氧缺位铁酸锌(ZnFe2OX)能处理含SO2 0.01%的尾气22400L(标准状况),则ZnFe2OX中的x=_________。
17.(福州三中2008-2009学年第一学期高三化学半期考)某课外兴趣小组为了探究碱性溶液中Mg2+、AlO2-与溶液pH的关系,进行下列实验:向含有0.1 mol HCl、0.1 mol MgCl2、1.0 mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1 L。测得部分实验数据如下表:
|
pH |
9 |
10 |
11 |
|
c(Mg2+)/ mol·L-1 |
10-1 |
10-3 |
10-5 |
|
c(AlO2―)/mol·L-1 |
10-2 |
10-1 |
1 |
试回答:
(1)若向混合溶液中加入NaOH溶液至pH=9,请用所给的实验数据判断,有否Mg(OH)2
沉淀出现________(填“能”或“否”),由此你得到的初步结论是__________________。
(2)若向混合溶液中加入NaOH溶液至pH=10,请写出反应各阶段所发生反应的离子
方程式__________,____________,_________________,________________,那么,所加入的NaOH溶液中溶质的的物质的量为_____________
16. (山东省聊城一中08-09高三期末综合)密度为1.45 g/cm3的硫酸中,逐渐滴入BaCl2溶液直到沉淀完全为止,测得沉淀质量与原硫酸溶液质量相等,则原硫酸溶液物质的量浓度为
( )
(山东省聊城一中08-09高三期末综合)密度为1.45 g/cm3的硫酸中,逐渐滴入BaCl2溶液直到沉淀完全为止,测得沉淀质量与原硫酸溶液质量相等,则原硫酸溶液物质的量浓度为
( )
A.6.22 mol/L B.12.22 mol/L C.15.8 mol/L D.16.8 mol/L
15.(山大附中2008-2009学年度下学期高三第一次月考)将x mol Al2O3和y mol CuO混合后,全部溶于V L过量的稀硫酸中,然后向溶液中逐渐加入0.5 mol/L的NaOH溶液,当加入a L时,生成的沉淀最多,则原稀H2SO4的物质的量浓度为 ( )
A. mol/L B.
mol/L B.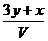 mol/L
C.
mol/L
C. mol/L
D.无法计算
mol/L
D.无法计算
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com