
18、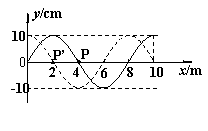 如右图为一列简谐横波的波形图,其中实线是t1=0.01s时的波形,虚线是t2=0.02s时的波形,已知t2−t1=
如右图为一列简谐横波的波形图,其中实线是t1=0.01s时的波形,虚线是t2=0.02s时的波形,已知t2−t1=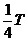 。关于这列波,下列说法中正确的是
。关于这列波,下列说法中正确的是
A.该波的传播速度可能是600m/s
B.从t1时刻开始,经0.1s质点P通过的路程为0.8m
C.若该波波源从0点沿x轴正向运动,则在x=200m处的
观测者接收到的波的频率将大于25Hz
D.遇到宽约3m的障碍物时,该波能发生明显的衍射现象
19、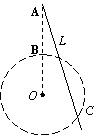 如右图所示,A、B、O、C为在同一竖直平面内的四点,其中A、B、O沿同一竖直线,B、C同在以O为圆心的圆周(用虚线表示)上,沿AC方向固定有一光滑绝缘细杆L,在O点固定放置一带负电的小球。现有两个质量和电荷量都相同的带正电的小球a、b,先将小球a穿在细杆上,让其从A点由静止开始沿杆下滑,后使小球b从A点由静止开始沿竖直方向下落。各带电小球均可视为点电荷,则下列说法中正确的是
如右图所示,A、B、O、C为在同一竖直平面内的四点,其中A、B、O沿同一竖直线,B、C同在以O为圆心的圆周(用虚线表示)上,沿AC方向固定有一光滑绝缘细杆L,在O点固定放置一带负电的小球。现有两个质量和电荷量都相同的带正电的小球a、b,先将小球a穿在细杆上,让其从A点由静止开始沿杆下滑,后使小球b从A点由静止开始沿竖直方向下落。各带电小球均可视为点电荷,则下列说法中正确的是
A.从A点到C点,小球a做匀加速运动
B.小球a在C点的动能大于小球b在B点的动能
C.从A点到C点,小球a的机械能先增加后减小,但机械能与电势能之和不变
D.从A点到C点电场力对小球a做的功大于从A点到B点电场力对小球b做的功
20、 在倾角为θ足够长的光滑斜面上,存在着两个磁感应强度相等的匀强磁场,磁场方向一个垂直斜面向上,另一个垂直斜面向下,宽度均为L,如图所示。一个质量为m、电阻为R、边长也为L的正方形线框在t=0时刻以速度v0进入磁场,恰好做匀速直线运动。若经过时间t0,线框ab边到达gg′与ff′中间位置时,线框又恰好做匀速运动,则下列说法正确的是
在倾角为θ足够长的光滑斜面上,存在着两个磁感应强度相等的匀强磁场,磁场方向一个垂直斜面向上,另一个垂直斜面向下,宽度均为L,如图所示。一个质量为m、电阻为R、边长也为L的正方形线框在t=0时刻以速度v0进入磁场,恰好做匀速直线运动。若经过时间t0,线框ab边到达gg′与ff′中间位置时,线框又恰好做匀速运动,则下列说法正确的是
A.当ab边刚越过ff′时,线框加速度的大小为3gsinq
B.t0时刻线框匀速运动的速度为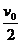
C.t0时间内线框中产生的热量为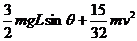
D.离开磁场的过程中线框将做匀速直线运动
第Ⅱ卷(本卷共10题,共180分)
21、I、(8分)
在一次实验中,某同学选用了两个外形相同的硬质小球A和B,小球A质量较大,小球B质量较小。该同学实验发现:若在水平面上用A球去撞击原来静止的B球,碰后A和B都向前运动;若用B球去撞击原来静止的A球,碰后A球向前运动,B球向后运动。
 为了探究碰撞中的不变量,该同学计划用如图所示的圆弧槽进行实验。实验时,分别将小球M、N放在竖直平面内的半圆形玻璃轨道内侧(轨道半径远大于小球半径)。现让小球M从与圆心O等高处由静止释放,在底部与静止的小球N发生正碰。
为了探究碰撞中的不变量,该同学计划用如图所示的圆弧槽进行实验。实验时,分别将小球M、N放在竖直平面内的半圆形玻璃轨道内侧(轨道半径远大于小球半径)。现让小球M从与圆心O等高处由静止释放,在底部与静止的小球N发生正碰。
(1)实验中,若实验室里有如下所述的四个小球:
①半径为r的玻璃球;
②半径为2r的玻璃球;
③半径为1.5r的钢球;
④半径为2r的钢球。
为了便于测量,该同学M球应选用 ,N球应选用 。(填编号)
(2)实验中不用测量的物理量为
①小球M的质量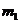 和小球N的质量
和小球N的质量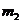 ;
;
②圆弧轨道的半径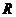 ;
;
③小球M碰后上升的最高处与O点连线偏离竖直方向的夹角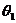 ;
;
④小球N碰后上升的最高处与O点连线偏离竖直方向的夹角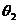 。
。
(3)用上述测得的物理量表示碰撞中的不变量的等式为: 。
II、(13分)
我们知道,将两个金属电极插入任何一个水果中就可以做成一个水果电池,但日常生活中我们很少用“水果电池”,这是为什么呢?某兴趣小组同学准备就此问题进行探究。
 (1)甲同学通过查阅资料获知,将锌、铜两电极插入水果中,电动势大约会有1伏多。乙同学找来了一个柠檬做实验(如图),当用量程为0-3V、内阻约20kΩ的电压表测其电压时读数为0.80V;丙同学将四个上述水果电池串起来给标称值为“1.5V,0.5A”的小灯泡供电时,灯泡并不发光。而用电压表测量其电压值为1.6V多。(不要求写分析、推导过程)出现这种现象的原因是:
。
(1)甲同学通过查阅资料获知,将锌、铜两电极插入水果中,电动势大约会有1伏多。乙同学找来了一个柠檬做实验(如图),当用量程为0-3V、内阻约20kΩ的电压表测其电压时读数为0.80V;丙同学将四个上述水果电池串起来给标称值为“1.5V,0.5A”的小灯泡供电时,灯泡并不发光。而用电压表测量其电压值为1.6V多。(不要求写分析、推导过程)出现这种现象的原因是:
。
(2)甲同学用欧姆表直接测“柠檬电池”的两极,读得此时的读数为30Ω。丙同学用灵敏电流表直接接“柠檬电池”的两极,测得电流为0.12mA,根据前面用电压表测得的0.80V电压,由全电路欧姆定律得: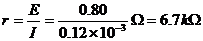 。因而甲同学说柠檬的内阻为30Ω,而丙同学则说是6.7kΩ。
。因而甲同学说柠檬的内阻为30Ω,而丙同学则说是6.7kΩ。
请你判断,用甲和丙同学的方法测量“柠檬电池”的内阻,结果是否准确,为什么?请分别说明理由。
(3)若实验室除了导线和开关外,还有以下一些器材可供选择:
 A.电流表A1(量程为0-0.6A ,内阻r1=1Ω)
A.电流表A1(量程为0-0.6A ,内阻r1=1Ω)
B.灵敏电流表A2(量程为0-0.6mA,内阻未知)
C.灵敏电流表A3(量程为0-150μA,内阻r2=500Ω)
D.滑动变阻器R1(最大阻值约10Ω)
E.滑动变阻器R2(最大阻值约2kΩ)
F.定值电阻R3 (阻值2kΩ)
G.变阻箱R4(0-9999Ω)
①为了能尽可能准确测定“柠檬电池”的电动势和内阻,实验中应选择的器材是
(填器材前的字母代号)。
②在右方框中画出应采用的电路。
22、(17分)如图所示,一高度为h=0.8m的粗糙水平面在B点处与一倾角为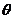 =30°的光滑斜面BC连接,一小滑块从水平面上的A点以v0=3m/s的速度在粗糙的水平面上向右运动。运动到B点时小滑块恰能沿光滑斜面下滑。已知AB间的距离S=1.8m,求:
=30°的光滑斜面BC连接,一小滑块从水平面上的A点以v0=3m/s的速度在粗糙的水平面上向右运动。运动到B点时小滑块恰能沿光滑斜面下滑。已知AB间的距离S=1.8m,求:
(1)小滑块与水平面间的动摩擦因数;
(2)小滑块从A点运动到地面所需的时间;
(3)若小滑块从水平面上的A点以v1=5m/s的速度在粗糙的水平面上向右运动,运动到B点时小滑块将做什么运动?并求出小滑块从A点运动到地面所需时间(取g=10m/s2)。

23、(18分)放置在竖直平面内的光滑绝缘轨道如图所示,其中BC为水平面,斜面AB与BC通过较小光滑圆弧连接,CDF是半径为R(R大小未知)的圆形轨道。一个质量为m、带电量为-q的小球,从距水平面BC高h处的P点由静止下滑,小球恰能通过竖直圆形轨道的最高点D而作圆周运动。试求:
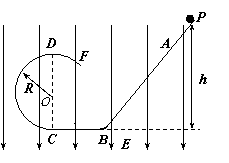 (1)圆形轨道半径R的大小;
(1)圆形轨道半径R的大小;
(2)现在竖直方向加方向竖直向下的足够大的匀强电场,且电场强度满足mg=2qE,若仍从P点由静止释放该小球,试判断小球能否通过圆形轨道的最高点D。若不能,说明理由;若能,求出小球在D点时对轨道的压力。
24、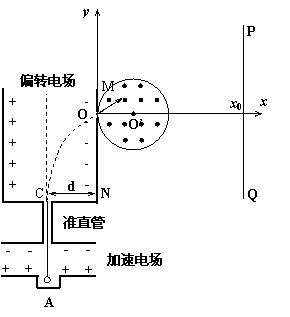 (22分)如图所示,在xOy平面内,离子源A产生的初速为零的同种带正电离子,质量m=1.0×10-20kg、带电量q=1.0×10-10C。离子经加速电场加速后匀速通过准直管并从C点垂直射入匀强偏转电场,偏转后通过极板MN上的小孔O离开电场,且粒子在O点时的速度大小为v=2.0×106m/s,方向与x轴成30°角斜向上。在y轴右侧有一个圆心位于x轴,半径r=0.01m的圆形磁场区域,磁场方向垂直纸面向外,磁感应强度B=0.01T,有一垂直于x轴的面积足够大的竖直荧光屏PQ置于坐标x0=0.04m处。已知NC之间的距离d=0.02m,粒子重力不计。试求:
(22分)如图所示,在xOy平面内,离子源A产生的初速为零的同种带正电离子,质量m=1.0×10-20kg、带电量q=1.0×10-10C。离子经加速电场加速后匀速通过准直管并从C点垂直射入匀强偏转电场,偏转后通过极板MN上的小孔O离开电场,且粒子在O点时的速度大小为v=2.0×106m/s,方向与x轴成30°角斜向上。在y轴右侧有一个圆心位于x轴,半径r=0.01m的圆形磁场区域,磁场方向垂直纸面向外,磁感应强度B=0.01T,有一垂直于x轴的面积足够大的竖直荧光屏PQ置于坐标x0=0.04m处。已知NC之间的距离d=0.02m,粒子重力不计。试求:
(1)偏转电场间电场强度的大小;
(2)粒子在圆形磁场区域的运动时间;
(3)若圆形磁场可沿x轴移动,圆心O’在x轴上的移动范围为[0.01m,+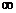 ),由于磁场位置的不同,导致粒子打在荧光屏上的位置也不同,求粒子打在荧光屏上点的纵坐标的范围。
),由于磁场位置的不同,导致粒子打在荧光屏上的位置也不同,求粒子打在荧光屏上点的纵坐标的范围。
25、(14分) A、B、C、D、E、F、G、H八种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E,B与G,D与H分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5个,D的最外层电子数是F的2倍,C和D的最外层电子数之和为11。请回答下列问题:
(1)以上八种元素中非金属所形成的最简单气态氢化物稳定性最弱的是(填化学式) , E、F、H所形成的简单离子的半径由大到小的顺序为(用离子符号表示) > > 。
(2)一定条件下,A的单质气体与C的单质气体充分反应生成 W气体,W的结构式________。由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y, X的电子式为 。固体化合物E2D2与化合物E2H的水溶液按物质的量比
1︰1反应生成单质H的离子方程式为 __
(3)G是非金属元素,其单质在电子工业中有重要应用,请写出G的最高价氧化物与B的单质在高温下发生置换反应的化学反应方程式 。
(4)在10 L的密闭容器中,通入2 mol的HD2气体和1 mol D2的气体单质,一定条件下反应后生成HD3气体,当反应达到平衡时,单质D的浓度为0.01 mol·L-1,同时放出约177KJ的热量,则平衡时HD2的转化率为 ;该反应的热化学方程式为__ ;此时该反应的平衡常数K= 。
26、(14分)KMnO4是一种常用的强氧化剂,工业上可以以软锰矿(主要成分MnO2)为原料,通过液相法生产。即在碱性条件下用氧气氧化MnO2得到K2MnO4,分离后得到K2MnO4,再用铂板作阳极,铁作阴极电解K2MnO4溶液得到KMnO4,简略生产过程如下所示:
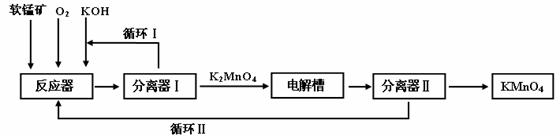
回答下列问题:
(1)写出反应器中反应的方程式
(2)生产过程中最好使用含MnO280%以上的富矿,因为MnO2含量最低的贫矿中Al的氧化物含量较高,会导致KOH消耗量偏高,用离子方程式表示KOH消耗偏高的原因 。
(3)写出电解槽中阴极和阳极的电极反应方程式
阴极: ;阳极: 。
在电解法中循环Ⅰ、Ⅱ中利用的共同物质是 。
(4)在传统工艺中,得到K2MnO4后,向其中通入CO2制备KMnO4,配平方程式:
K2MnO4+ CO2= KMnO4+ MnO2+ K2CO3
将所得KMnO4配成0.1 mol·L-1 KMnO4溶液,滴定20.00mL未知浓度的FeCl2溶液,消耗KMnO4溶液30.00mL,则FeCl2溶液的浓度为___________mol/L。
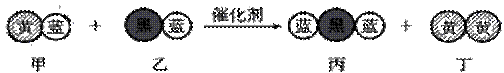 27、(16分)(1)“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法不正确的是( )
27、(16分)(1)“三效催化转换器”可将汽车尾气中的有毒气体处理为无污染的气体,下图为该反应的微观示意图(未配平),其中不同符号的球代表不同种原子。下列说法不正确的是( )
A.乙和丙中所含元素种类相同 B.甲和丁中同种元素化合价不相等
C.该反应中共有三种元素 D.化学方程式中乙、丁的化学计量数均为l
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3与NOx反应生成无毒的物质。某同学采用以下装置和步骤模拟工业上氮的氧化物处理过程。
提供的装置:
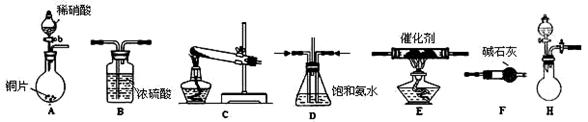
步骤一、NH3的制取
①所提供的装置中能快速、简便制取NH3的装置是: (填装置序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如下表:
|
试剂组合序号 |
固体试剂(g) |
NH3体积(mL) |
|
|
a |
12.0g
Ca(OH)2 (过量) |
10.8g NH4Cl |
2688 |
|
b |
10.8g (NH4)2SO4 |
2728 |
|
|
c |
12.0g
NaOH (过量) |
10.8g NH4Cl |
3136 |
|
d |
10.8g (NH4)2SO4 |
3118 |
|
|
e |
12.0g CaO
(过量) |
10.8g NH4Cl |
3506 |
|
f |
10.8g (NH4)2SO4 |
3584 |
分析表中数据,实验室制NH3产率最高的是: (填序号),其它组合NH3产率不高的原因是: 。
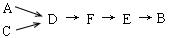 步骤二、模拟尾气的处理
步骤二、模拟尾气的处理
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
①A中反应的离子方程式: 。
②D装置作用有:使气体混合均匀、调节气流速度,还有一个作用是: 。
③D装置中的液体可换成 (填序号)。
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是: 。
28、 (14分)肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得H分子的红外光谱如下图:

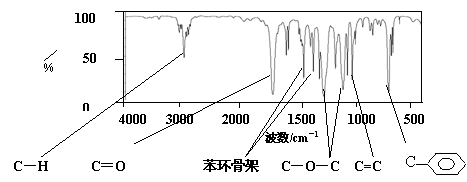

又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。
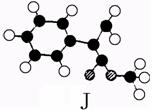
试回答下列问题。
(1)肉桂酸甲酯(H)的结构简式为 。
(2)现测出A的核磁共振氢谱谱图有6个峰,其面积之比为1︰2︰2︰2︰1︰2。
用芳香烃A 为原料合成H的路线如下:
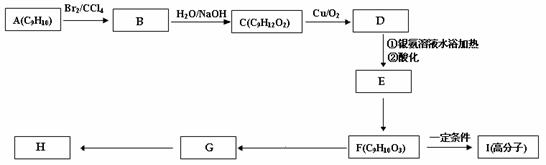
① 化合物F中的官能团有 (填名称)。
② B→C的反应类型是 ,F→G的反应类型是 ,
③ 书写化学方程式
F→I
G→H
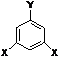
④ 其中F的同分异构体甚多,其中有一类可用通式 表示(其中X、Y均不为氢),
试写出符合上述通式且能发生银镜反应的四种物质的结构简式
、
、
29、(20分) 回答应下列Ⅰ、Ⅱ小题:
Ⅰ.(6分)为研究促甲状腺激素(TSH)分泌的影响因素,研究者从刚宰杀的大白鼠体内分离新鲜的下丘脑和脑垂体,然后把这些结构单独或一起培养于含有或不含有甲状腺激素的培养基中,培养后测定培养基内TSH的浓度,结果如下:

(1)在上述实验中设置A瓶的目的是什么?
(2)将以上装置中的实验结果进行相互比较,可以得出哪些结论?
II.(14分)生长素能促进细胞伸长生长,其作用机理的某种假说指出:生长素是以扩散作用通过细胞壁,然后与细胞膜上的蛋白质结合。这种结合激活了细胞膜上转运氢离子的载体,将氢离子向膜外运输,使细胞壁酸化,酸化后的细胞壁变得松驰,水分通过渗透作用进入细胞产生压力,使细胞伸长生长。为了探究生长素是否是以酸化细胞壁的方式促进细胞生长,某研究小组用燕麦胚芽鞘为实验材料,并设计了实验步骤,请将实验步骤补充完整并写出实验预期和相应结论。
17、 如右图所示,一束单色光从一折射率为
如右图所示,一束单色光从一折射率为 的平板玻璃砖的上表面A点以60°入射角射入,经过时间t1穿过玻璃砖从下表面射出。若把玻璃砖取走,该单色光将通过B点,且从A到B的时间为t2。则t1与t2比较,正确的是
的平板玻璃砖的上表面A点以60°入射角射入,经过时间t1穿过玻璃砖从下表面射出。若把玻璃砖取走,该单色光将通过B点,且从A到B的时间为t2。则t1与t2比较,正确的是
A.t1> t2 B.t1= t2
C.t1< t2 D.以上情况都有可能
16、 氢原子能级的示意图如右图所示,大量氢原子从n=4的能级向n=2的能级跃迁时辐射出可见光a,从n=3的能级向n=2的能级跃迁时辐射出可见光b,则
氢原子能级的示意图如右图所示,大量氢原子从n=4的能级向n=2的能级跃迁时辐射出可见光a,从n=3的能级向n=2的能级跃迁时辐射出可见光b,则
A.氢原子从高能级向低能级跃迁时吸收能量
B.在n=2能级时氢原子可吸收任意频率的光子而发生电离
C.处于n=2能级的氢原子可以吸收a光子跃迁到n=4的激
发态
D.b光照射逸出功为2.49 eV的金属钠能发生光电效应
15、随着太空技术的飞速发展,地球上的人们登陆其它星球成为可能。假设未来的某一天,宇航员登上某一星球后,测得该星球表面的自由落体加速度为地球表面重力加速度的2倍,而该星球的平均密度与地球差不多,则该星球质量大约是地球质量的
A.2倍 B.4倍 C.6倍 D.8倍
14、 如右图所示,顶角为直角、质量为M的斜面ABC放在粗糙的水平面上,
如右图所示,顶角为直角、质量为M的斜面ABC放在粗糙的水平面上,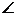 A=30°,
A=30°,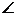 B=60°,且斜面与水平面间动摩擦因数为
B=60°,且斜面与水平面间动摩擦因数为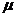 。现沿垂直于BC方向对斜面施加一力F,斜面仍保持静止状态,则关于斜面受到地面对它的支持力N和摩擦力f的大小,正确的是(已知重力加速度为g)
。现沿垂直于BC方向对斜面施加一力F,斜面仍保持静止状态,则关于斜面受到地面对它的支持力N和摩擦力f的大小,正确的是(已知重力加速度为g)
A.N=Mg,f=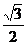 F
B.N=Mg+
F
B.N=Mg+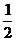 F,f=
F,f=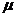 Mg
Mg
C.N=Mg+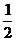 F,f=
F,f=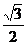 F D.N=Mg+
F D.N=Mg+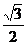 F,f=
F,f=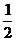 F
F
13、已知几种难溶电解质的溶度积常数(25℃)见下表
|
难溶电解质 |
AgCl |
AgBr |
AgI |
Ag2SO4 |
Ag2CrO4 |
|
Ksp |
1.8×10-10 |
5.4×10-13 |
8.5×10-17 |
1.4×10-5 |
1.12×10-12 |
下列对AgCl 、AgBr、 AgI、Ag2SO4、Ag2CrO4叙述不正确的是
A.Ksp的大小与三种卤化银见光分解的难易无关
B.将等体积的4×10-3mo1·L-1的AgNO3和4×10-3mo1·L –1 K2CrO4混合,有Ag2CrO4沉淀产生
C.向AgCl的悬浊液中滴加NaI的饱和溶液可以得到黄色AgI悬浊液
D.向100mL0.1 mol·L-1的Na2SO4溶液中加入1 mL0.1 mol·L-1的AgNO3溶液,有白色沉淀生成
12、下列叙述中不正确的是
A.在0.1 mol·L-1NH4Cl溶液中:c(H+) + c(NH4+)= c(Cl-) + c(OH-)
B.在常温下,10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C.pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaHCO3溶液:
c(CH3COONa)>c(NaHCO3) >c(Na2CO3 ) >c(C6H5ONa )
D.25℃时,c(NH+4)相等的(NH4)2SO4溶液、(NH4)2Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl)
11、某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g) + xB(g)  2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
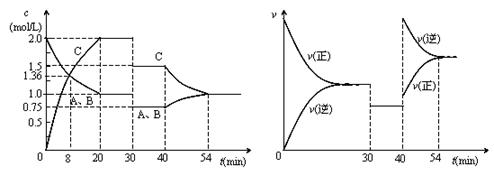 A.30min-40min间该反应使用了催化剂
A.30min-40min间该反应使用了催化剂
B.反应方程式中的x=1,正反应为吸热反应
C.30min时降低温度,40min时升高温度
D.8min前A的平均反应速率为0.08mol·L-1·min-1
10、迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如右图。下列叙述正确的是
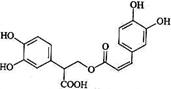 A.迷迭香酸属于芳香烃
A.迷迭香酸属于芳香烃
B.迷迭香酸可以发生水解反应、取代反应和酯化反应
C.1mol迷迭香酸最多能和9mol氢气发生加成反应
D.1mol迷迭香酸最多能和含5mol NaOH的水溶液完全反应
9、下列结论均出自《实验化学》中的实验,其中不正确的是
A.往新配制的可溶性淀粉溶液中滴加碘水,溶液显蓝色,用CCl4不能从中萃取出碘。
B.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,此现象可作为判断镀锌铁皮中锌镀层是否完全被反应掉的依据。
C.提取海带中碘元素时,为保证I-完全氧化为I2,加入的氧化剂(H2O2或新制氯水)均应过量。
D.制备硫酸亚铁铵晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液表面出现晶膜为止,不能将溶液全部蒸干。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com