
8.如图,一长为,的轻质细杆一端与质量为m的小球(可
视为质点)相连,另一端可绕O点转动,现使轻杆在同
一竖直面内作匀速转动,测得小球的向心加速度大小为
g(g为当地的重力加速度),下列说法正确的是( )
A.小球的线速度大小为gl
B.小球运动到最高点时处于完全失重状态
C.当轻杆转到水平位置时,轻杆对小球作用力方向
不可能指向圆心O
D.轻杆在匀速转动过程中,轻杆对小球作用力的最大值为mg
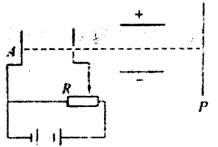 9.如图所示,A板发出的电子经加速后,水平射入水平放置的两平行金属板间,金属板间所加的电压为U,电子最终打在光屏P上,关于
9.如图所示,A板发出的电子经加速后,水平射入水平放置的两平行金属板间,金属板间所加的电压为U,电子最终打在光屏P上,关于
电子的运动,则下列说法中正确的是 ( )
A.滑动触头向左移动时,其他不变,则电子打
在荧光屏上的位置上升
B.滑动触头向右移动时,其他不变,则电子打
在荧光屏上的位置上升
C.电压U增大时,其他不变,则电子从发出到
打在荧光屏上的时间不变
D.电压U增大时,其他不变,则电子打在荧光屏上的速度大小不变
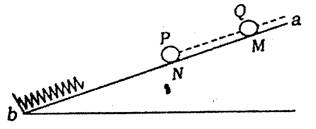 10.如图,绝缘弹簧的下端固定在斜面底端,弹簧与斜面平行且初始为自然长度,带电小球Q(可视为质点)固定在光滑斜面的M点,并处于通过弹簧中心的直线ab上。现将小球P(也视为质点)从直线ab上的N点由静止释放,设小球P与Q电性相同,则小球从释放到运动至最低点的过程中下列说法正确的是 ( )
10.如图,绝缘弹簧的下端固定在斜面底端,弹簧与斜面平行且初始为自然长度,带电小球Q(可视为质点)固定在光滑斜面的M点,并处于通过弹簧中心的直线ab上。现将小球P(也视为质点)从直线ab上的N点由静止释放,设小球P与Q电性相同,则小球从释放到运动至最低点的过程中下列说法正确的是 ( )
A.小球P的速度先增大后减小
B.小球P的速度最大时所受弹簧
弹力与库仑力的合力为零
C.小球P的动能,重力势能,
电势能的总和不变
D.小球P所受重力、弹簧弹力
和库仑力做功的代数和等于
电势能的变化量的大小
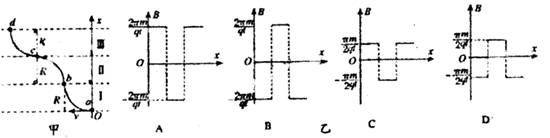 11.如图甲所示,一个质量为m、电荷量为+q的带电粒子,不计重力。在a点以某一初速度水平向左射入磁场区域I,沿曲线abcd运动,ab、bc、cd都是半径为R的圆弧。粒子在每段圆弧上运动的时间都为t。规定由纸面垂直向外的磁感应强度为正,则磁场区域I II III三部分的磁感应强度B随x变化的关系可能是乙图中的 ( )
11.如图甲所示,一个质量为m、电荷量为+q的带电粒子,不计重力。在a点以某一初速度水平向左射入磁场区域I,沿曲线abcd运动,ab、bc、cd都是半径为R的圆弧。粒子在每段圆弧上运动的时间都为t。规定由纸面垂直向外的磁感应强度为正,则磁场区域I II III三部分的磁感应强度B随x变化的关系可能是乙图中的 ( )
7.甲乙两人同时观察同一单摆的振动,甲每经过2.0s观察一次摆球的位置,发现摆球都在其平衡位置处:乙每经过3.0s观察一次摆球的位置,发现摆球都在平衡位置右侧的最高 处,由此可知该单摆的周期可能是 ( )
 A.0.5s B.1.0s C.2.0s D.3.0s
A.0.5s B.1.0s C.2.0s D.3.0s
35.(16分)[化学-选修有机化学基础]
苯酚是重要的化工原料,通过下列流程可合成阿司匹林(乙酰水杨酸)、香料、和一些高分子化合物。
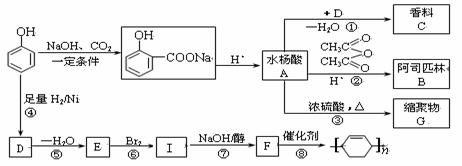
根据上面的流程图,回答下列问题:
(1)写出香料C的结构简式_________________________________________。
(2)写出反应②的化学方程式______________________________________________。
(3)写出缩聚物G的结构简式_____________________________________________。
(4)写出反应⑧的化学方程式______________________________________________。
(5)写出反应类型:④________________________、 ⑦_________________________。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是______________________。
(a)三氯化铁溶液 (b)碳酸氢钠溶液 (c)石蕊试液
(7)水杨酸A的同分异构体有多种,其中苯基上含有两个取代基的同分异构体有______种。
34.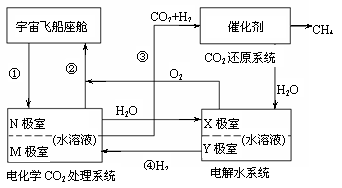 (16分)(化学―选修化学与生活)
(16分)(化学―选修化学与生活)
已知每人每天要消耗0.9kg O2,呼出1.0kg CO2。为使载人飞船座舱内空气成分稳定, 科学家根据电解原理设计了飞船内空气更新的实验系统,该系统的结构示意图如右图所示:
(1)管通①把含较多CO2的潮湿空气通入N极室,通过该电极反应可使CO2不断被吸收,该电极反应为 ,其电解产物吸收CO2的离子方程式是 。在N极吸收CO2后形成的离子能通过隔膜进入M极室,通过M极的电极反应可使CO2从电解液中释放出来,并保持系统内的pH不变,该电极反应为 ,有CO2逸出的离子方程式为 。
(2)管道②是将处理后的空气混入“电解水系统”产生的新鲜O2中,然后通入飞船座舱内供宇航员呼吸,在“电解水系统”中X极的电极反应为
。
(3)为实现上述电解过程科学家使用了一种银锌高能电池,该电池的正极活性材料是Ag2O和少量石墨组成,负极材料是锌汞合金,电解质溶液为浓KOH溶液,已知电池内总反应为: Ag2O+Zn=ZnO+2Ag。则负极的电极反应为__________________________________,正极的电极反应为_____________________________________, OH―离子向____________极移动。
27.(12分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:
2NO+2CO  2CO2+N2
2CO2+N2
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
|
时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)/ mol·L-1 |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)/ mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)写出该反应的平衡常数表达式K= 。
(2)前2s内的平均反应速率v(N2)=_____________。
(3)在上述条件下反应能够自发进行,则反应的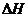 0(填写“>”、“<”、“=”)。
0(填写“>”、“<”、“=”)。
(4)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高NO转化率的是 。
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积
(5)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中,请在表格中填入剩余的实验条件数据。
|
实验编号 |
T/℃ |
NO初始浓度 mol·L-1 |
CO初始浓度 mol·L-1 |
催化剂的比表面积 ㎡·g-1 |
|
Ⅰ |
280 |
1.2×10-3 |
5.8×10-3 |
82 |
|
Ⅱ |
|
|
|
124 |
|
Ⅲ |
350 |
|
|
124 |
26.(14分) A、B、C、D、E、F是元素周期表中连续三个短周期的元素,且原子序数依次增大。A与D同主族,B、C同周期且相邻,C的最外层电子数是次外层的3倍,C、D的最外层电子数之和与F的最外层电子数相等,E的简单离子为同周期中离子半径最小的。回答下列问题:(1)A与B形成的一种液态化合物M与C的一种单质的摩尔质量相等,则M的化学式为 。
(2)A和C形成的一种具有氧化性的液态化合物N与M恰好完全反应,产生两种无毒又不污染环境的物质X和Y。已知:常温常压下1mol M与氧气反应生成X和Y放出的热量为Q1 kJ,N发生分解反应生成1 mol C单质时吸收的热量为Q2 kJ。请写出M与N反应的热化学方程式 。
(3)A与B可形成另一种气态化合物Z,写出实验室制取Z的化学方程式 。
(4)六种元素中其中三种元素组成的某种盐,水溶液显碱性,是家用消毒剂的主要成分,请用离子方程式解释该盐溶液呈碱性的原因 。
(5)写出E的单质与D的最高价氧化物的水化物反应的化学方式
。
(6)写出F的单质与D的最高价氧化物的水化物反应的离子方程式
。
25.(16分)实验室用燃烧法测定某种氨基酸(CxHyOzNp)的分子组成。取w g该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
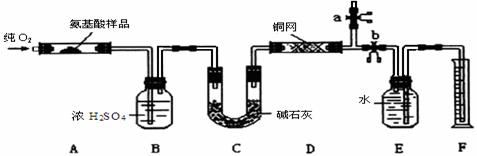
(1) 实验开始时,首先打开止水夹a,通一段时间纯氧,这样做的目的是___ ___;之后则需关闭止水夹a,打开止水夹b。
(2) 以上装置中需要加热的有(填装置代号)_________。操作时应先点燃_______处的酒精灯。
(3) 装置A中发生反应的化学方程式为_____________________________________;
(4) 装置D的作用是_____________________________________________________;
(5) 读取N2所排水的体积时,要注意:①_______________________________________;
②___________________________________________________________。
(6) 实验中测得N2的体积为VmL(已换算成标准状况)。为确定此氨基酸的分子式,还需要得到的数据有(填字母)_______________________。
A.生成二氧化碳气体的质量 B.生成水的质量
C.通入氧气的体积 D.该氨基酸的摩尔质量
(7)如果将装置中B、C的连接顺序变为C、B,该实验的目的能否达到?____________,
简述理由____________________________________________________________。
13.25℃时,浓度均为0.2 mol·L-1的NaHCO3和Na2CO3溶液中,下列判断正确的是
A.后者仅存在水解平衡,不存在电离平衡
B.两溶液中存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)前者增大后者减小
第Ⅱ卷 非选择题(共 174 分)
12.设NA代表阿伏加德罗常数的数值,下列说法中正确的是
① 常温常压下,8 g甲烷(12CH4)所含的中子数为5NA
② 常温常压下,22.4 L N2气体的分子数小于NA
③ 64 g的铜发生氧化还原反应,一定失去2NA个电子
④ 常温常压下,0.5 mol·L-1的乙酸溶液中,乙酸的分子数目略小于0.05NA
⑤ 标准状况时,22.4 L 氧单质中氧原子数可能为2.5 NA
⑥ 常温常压下,1mol氦气分子含有的核外电子数为4NA
A.①② B.③④ C.②⑤ D.⑤⑥
11.Fe3+、SO42-、Al3+和X四种离子以物质的量之比2∶4∶1∶1大量共存于同一溶液中,则X可能是
A.Na+ B.OH- C.CO32- D.Cl-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com