
17.(1) _______极反应物。
(2)化学键是___ ___。
(3) ______能。_________ ______。
(4) K=_______ (保留一位小数),CO2转化率为 _________, _______热反应(填“吸”或“放”)。
(5) _________ ____。
16.步骤一:阴极上的电极反应式为 ;硫酸铜的浓度变化 ;
步骤二:(1)
(2) Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1。
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
|
|
|
|
|
|
|
|
|
19.(13分)氯化亚铜(CuCl)在石油工业生产中常用作脱硫剂和脱色剂。工业生产氯化亚铜的一种工艺流程如下图所示:
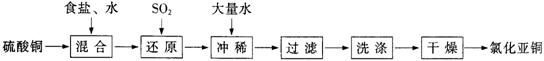
已知:①CuCl难溶于水和乙醇,干燥的CuCl在空气中比较稳定,但湿的CuCl在空气中易发生水解和氧化;②CuCl溶于氯化钠的浓溶液可生成CuCl2-,CuCl2-的溶液用水稀释可生成CuCl沉淀,反应式为CuCl2-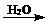 CuCl↓+Cl―。
CuCl↓+Cl―。
⑴.往CuSO4和NaCl混合液中通入SO2可生成CuCl2-和硫酸,请写出反应的离子方程式:____________________________。
⑵.在反应⑴中,温度升至70-80℃,并使用NaCl浓溶液,主要目的是______。
⑶.在反应⑴中,还原剂除了可用SO2外,还可选用______(填标号)。
A.Na2SO3 B.Cu C.Ag
⑷.过滤所得沉淀须迅速用____(填“水”或“95%乙醇”)洗涤、干燥得CuCl成品。
⑸.合成氨工业生产中的CO会使催化剂中毒,可通过下列反应除去。
[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g)=[Cu(NH3)3]Ac·CO(aq) △H<0,生产中为了提高CO的吸收率,可采用的措施是__________。(至少写出一种)
⑹.CuOH不稳定易分解为Cu2O。298K时,CuOH的Ksp=1.0×10-14,CuCl的Ksp=1.2×10-6。把CuCl固体和NaOH溶液混合,加热,得到红色沉淀,该沉淀的化学式为______。
建阳一中、邵武一中、建瓯一中高三上期期末化学联考答题卷
18.(18分)某化学兴趣小组测定某FeCl3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
① 称取a g样品,置于烧杯中;
② 加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③ 量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干 燥器中冷却至室温后,称量;
燥器中冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
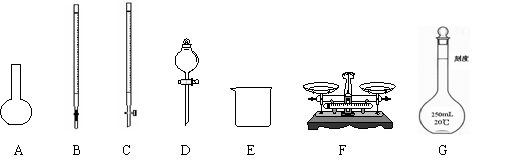
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器是E和 (填字母)。
(2)步骤②中加入盐酸的作用________________________________________________。
(3)写出步骤④中发生反应的离子方程式 。
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
___Fe2+ + ___ClO3- + = __Fe3+ + ___Cl- + ___H2O
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成 (填偏大、偏小或不影响),等物质的量的NaClO3与Cl2的氧化效率之比为
(5)第⑥步的操作中,将沉淀物转移到 (填仪器名称)中加热, 冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是
。
冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2g,若m1与m2差值较大,接下来的操作应当是
。
(6)本实验需要称量的最少次数是 次,若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为 。(列出算式,不需化简)
17.(16分)短周期主族元素X、Y、Z、W的原子序数依次增大,其中X、Y、Z位于不同周期,Y是形成化合物种类最多的元素,W2+与Ne原子具有相同的电子层结构。
⑴.由X、Y组成的最简单化合物可作某一燃料电池的____极反应物。
⑵.Z与氧组成的某种化合物可作为潜水员的供氧剂,该化合物中含有的化学键是__。
⑶.即热饭盒中,有W的单质与铁粉、固体食盐组成混合物A,使用时将水加入A中,几分钟后饭菜变热了。从能量转化角度看,该过程是化学能转化为____能。写出W与水反应的化学方程式:_______________________。
⑷.500℃时,密闭容器中充入1 mol/L CO2和3 mol/L H2发生反应:
CO2(g)+3H2(g)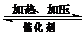 CH3OH(g)+H2O(g),测得有关数据如下:
CH3OH(g)+H2O(g),测得有关数据如下:
|
反应时间/min |
3 |
5 |
7 |
10 |
13 |
|
c(CO2)/mol·L-1 |
0.50 |
0.37 |
0.30 |
0.25 |
0.25 |
500℃时该反应的平衡常数K=____(保留一位小数),平衡时CO2的转化率为______,温度升高,K值增大,则正反应为____热反应(填“吸”或“放”)。
⑸.已知:298K时,Ca(s)=Ca2+(g)+2e- △H=+1807 kJ/mol
1/2O2(g)+2e-=O2―(g) △H=+986 kJ/mol
Ca2+(g)+O2―(g)=CaO(s) △H=-3528.5 kJ/mol
298K时,金属钙和氧气反应生成CaO固体的热化学方程式为_________。
16、(8分)已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不不反应)。某化学兴趣小组在实验室条件下用以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。
步骤一:电解精制:
请回答以下问题:
电解时,阴极上的电极反应式为 ;电解过程中,硫酸铜的浓度变化 ;
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
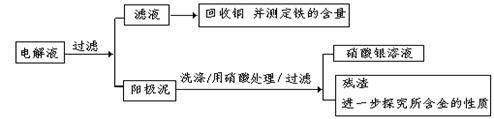
(1)阳极泥的综合利用:稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:
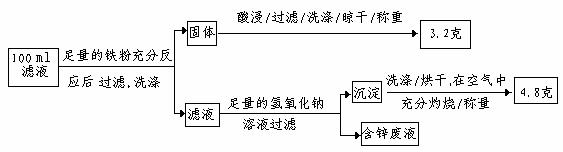
则100ml滤液中Cu2+ 的浓度为 mol·L-1 ,Fe2+的浓度为 mol·L-1。
15.某无色溶液中只可能含有①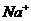 ②
②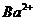 ③
③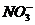 ④
④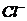 ⑤
⑤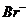 ⑥
⑥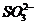 ⑦
⑦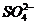 离子中的若干种(忽略水电离出的
离子中的若干种(忽略水电离出的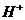 、
、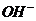 ),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
),依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。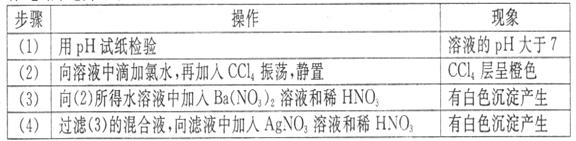
下列结论正确的是
A.肯定很有离子是④⑤⑥ B.肯定没有离子是②③⑤
C.可能含有的离子是①⑤⑥ D.不能确定的例子是③④⑦
14.
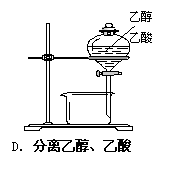
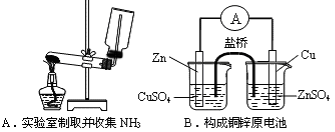 下列装置或操作能达到实验目的的是
下列装置或操作能达到实验目的的是
13.25℃时,有关弱酸的电离平衡常数如下:
|
弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
|
电离平衡常数(25℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
下列有关说法正确的是 ( )
A.等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2CO3)>pH(NaCN)
B.a mol·L-1 HCN溶液与b mol·L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com