
15.(12分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:

已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
⑴在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 ▲ 。
⑵加入碳酸钠调节pH至a,a的范围是 ▲ 。
⑶操作Ⅰ包含3个基本实验操作,它们是 ▲ 和过滤。
⑷制得的CoCl2·6H2O需减压烘干的原因是 ▲ 。
⑸为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 ▲ 。
⑹在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是 ▲ 。
14.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况)。下列说法正确的是
A.原混合溶液中c(K+)为2 mol/L B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为4mol/L
13. 在其他条件不变时,改变某一条件对A2(g)+3B2(g)
在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度)。下列结论正确的是
2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度)。下列结论正确的是
A.a、c两点A2的转化率相等
B.正反应一定是吸热反应,且T2>T1
C.b点时,平衡体系中A、B原子数之比为1:3
D.向a点的平衡体系中加入A2,可达到b点的平衡状态
12.下列溶液中各微粒的浓度关系正确的是
A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+)
B.0.1 mol/L pH=9的NaNO2溶液中:c(Na+)>c(NO2-)>c(OH-) >c(H+)
C.向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)= c(HCO3-)+2c(CO32-)
D.将10 mL 0.1 mol/LNa2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中:
c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
11.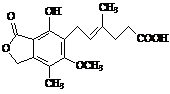 麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示。下列有关麦考酚酸说法正确的是
麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示。下列有关麦考酚酸说法正确的是
A.分子式为C17H22O6
B.不能与FeCl3溶液发生显色反应
C.在一定条件下可发生加成、取代、消去反应
D.1 mol麦考酚酸最多能与3 mol NaOH反应
10.下列说法中正确的是
A.Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取金属Mg
B.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
C.BaCl2溶液能使含酚酞的Na2CO3溶液红色褪去,其原因是BaCl2溶液呈酸性
D.硬水含有Ca2+、Mg2+、HCO3-、SO42-,煮沸可以完全除去其中的Ca2+、Mg2+
9.下列离子方程式正确的是
A.向水中通入氯气:Cl2+H2O=2H++ClO-+Cl-
B.向明矾溶液中加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.向Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
D.向Na2FeO4溶液中加入稀硫酸,迅速反应产生Fe2(SO4)3:
4FeO42-+20H+=4Fe3++3O2↑+10H2O
8.短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是
A.四种元素的原子半径:A>B>C>D
B.最高价氧化物对应的水化物的酸性:B>D
C.C元素处于元素周期表中第3周期第ⅡA族
D.B、D的最高价氧化物中,B、D与氧原子之间均为单键
7.下列溶液中,离子一定能大量共存的是
A.pH=l的溶液中:Na+、Mg2+、SO42-、HCO3-
B.含有大量Fe3+的溶液中:Al3+、Cu2+、Cl-、SO42-
C.加入Al能放出H2的溶液中:K+、NH4+、NO3-、Cl-
D.水电离产生的c(H+) =10-12mol/L-1的溶液中:K+、Ba2+、NO3-、OH-
6.设NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA
B.常温下,1 molO2和O3的混合气体中所含氧原子数为2.5NA
C.标准状况下,11.2 L的乙烯中含有的共用电子对数为NA
D.13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com