
6.气象卫星发送回地面的红外云图是由设置在卫星上具有接收云层辐射的红外线感应器完成的,云图上的黑白程度由辐射红外线的云层的温度高低决定,这是利用了红外线的
A.不可见性 B.穿透性 C.热效应 D.化学效应
5.纳米科技是跨世纪新科技,将激光束的宽度聚光到纳米级范围内,可修复人体已损坏的器官,对DNA分子进行超微型基因修复,把至今尚令人类无奈的癌症、遗传疾病彻底根除.这是利用了激光的
A.单色性 B.方向性 C.高能量 D.粒子性
4.关于光谱,下面说法中正确的是
A.霓虹灯和煤气灯火焰中燃烧的钠蒸气产生的光谱都是明线光谱
B.太阳光谱中的暗线说明太阳上缺少与这些暗线相应的元素
C.线状光谱和暗线光谱都可用于对物质成分进行分析
D.发射光谱一定是连续光谱
3.以下说法中正确的是
A.当光的波长比圆孔直径小时,可产生明显的衍射现象
B.衍射现象的研究表明,光沿直线传播只是一种近似规律
C.用平行单色光垂直照射不透明小圆板,在圆板后面的屏上发现圆板阴影中心处有一亮斑,这是光的干涉现象
D.用平行单色光垂直照射一把刀片,发现刀片的阴影边缘模糊不清,这是光的衍射现象
2.关于薄膜干涉,下述说法中正确的是
A.干涉条纹的产生是由于光在膜的前后两表面反射,形成的两列光波叠加的结果
B.干涉条纹中的暗纹是由于上述两列反射光的波谷与波谷叠加的结果
C.干涉条纹是平行等间距的平行线时,说明膜的厚度处处相等
D.观察薄膜干涉条纹时,应在入射光的同一侧
1.在双缝干涉实验中,以白光为光源,在屏幕上观察到了彩色干涉条纹.若在双缝中的一缝前放一红色滤光片(只能透过红光),另一缝前放一绿色滤光片(只能透过绿光),这时
A.只有红色和绿色的双缝干涉条纹,其他颜色的双缝干涉条纹消失
B.红色和绿色的双缝干涉条纹消失,其他颜色的双缝干涉条纹依然存在
C.任何颜色的双缝干涉条纹都不存在,但屏上仍有光亮
D.屏上无任何光亮
28.答案解析:(难)(1)设ClO2、Na2FeO4、Cl2的质量均为1 g,则被还原时,它们得到电子的物质的量分别为:ClO2 :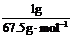 ×5=0.074 mol;Na2FeO4
:
×5=0.074 mol;Na2FeO4
: ×3=0.018 mol;Cl2
:
×3=0.018 mol;Cl2
: ×2=0.028 mol。故三种物质的消毒效率由大到小的顺序是ClO2>Cl2>Na2FeO4。
×2=0.028 mol。故三种物质的消毒效率由大到小的顺序是ClO2>Cl2>Na2FeO4。
(2)铁酸钠在消毒时,被还原为Fe3+,Fe3++3H2O Fe(OH)3+3H+,水解生成的Fe(OH)3胶体表面积较大,具有吸附性能,可吸附水中悬浮的杂质。
Fe(OH)3+3H+,水解生成的Fe(OH)3胶体表面积较大,具有吸附性能,可吸附水中悬浮的杂质。
(3)由题所给信息,二氧化氯的物理性质可知,二氧化氯被收集在B装置中,为提高收集效果,应补加冷凝装置。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐,所以尾气可用NaOH溶液吸收,发生歧化反应,生成NaClO2和NaClO3混合盐。
28.(本小题15分)用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是 > > 。
(2)铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是:
。

(3)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置 ;
②C中应装的试剂为 。C中发生反应的化学方程式为:
。
27.答案解析:(中难)抓住反应①、③是工业生产中的重要反应这个突破口,再结合A是固体,得出:反应①是煅烧FeS2制SO2,X是无色液体,应为水,③是制SO3,②是固体B与水作用产生O2,则固体B为过氧化钠,其他就好解了。参考答案归纳如下:
(1) 2Na2O2+2H2O===4NaOH+O2↑(2分)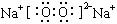 (2分)
(2分)
(1)离子键、非极性键 (3分,答出1个只给1分)
(2)Fe2O3 + 6H+ = 2Fe3+ + 3H2O(2分)
Fe2(SO4)3 + 6NaOH = 2Fe(OH)3↓+3Na2SO4(2分)
(3)FeS2(s) + 11/4 O2(g) = 1/2 Fe2O3(s)+ 2SO2(g);△H=-852kJ/mol(4分)
技能空间:本题解题突破口是“重要工业生产反应”。中学重要工业生产反应有:1.煅烧石灰石 2.煅烧黄铁矿 3.二氧化硫的催化氧化 4.氨的催化氧化 5.合成氨 6.电解饱和食盐水 7.工业制盐酸 8.高炉炼铁 9.工业制取漂粉精 10.工业制水煤气 11.硅酸盐工业等。
应试策略:有一类框图推断题,考查中学所学的工业生产原理,并结合元素化合物的知识,综合考查工业生产中常见化合物的性质,有一定的综合性。题目有一定难度,除有扎实的基本功外,还要有一定灵活运用知识的能力,较强的推理能力。
27.(本小题15分)根据下列框图关系填空,已知反应①、③是工业生产中的重要反应,D、E常温下为气体、X常温下为无色液体,H与E相对分子质量之间的关系为:Mr(H) -Mr(E) =34,又知C焰色反应火焰呈黄色。
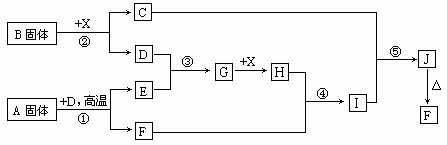
(1) 反应②的化学方程式:__________________________________;
产物C的电子式:_______________________。
(1)化合物A中所包含的化学键有:_______________________。
(2)反应④的离子方程式:_______________________________。
反应⑤的化学方程式:__________________________________。
(3)已知每生成16g E,放出106.5 kJ热量,则反应①的热化学方程式为:
_________________________________________________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com