
27、工业上用铝土矿(含氧化铝、氧化铁)制取金属铝的生产过程如下框图
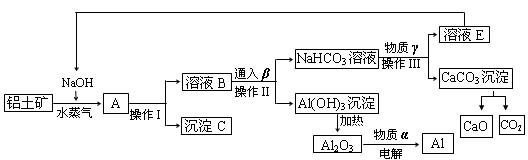
请回答下列问题:
(1)写出铝土矿与氢氧化钠溶液反应的离子方程式 。
(2)沉淀C的化学式为______,该物质除了用于金属冶炼以外,还可用作 。电解熔融的氧化铝时,物质α是______,其作用是 。
(3)在实验室中欲从溶液E中得到较纯净的固体NaOH,需要进行的操作顺序是:_______、趁热过滤、__________、 。
(4)生产过程中,可以循环使用的物质有四种,除NaOH、H2O以外,另外两种物质是
______、 (填化学式)。
26、 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:
(1)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3 更为合理,其理由是 _____________
_________________________________
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为 ,检查该装置气密性的方法是 _
______________________ ,实验中需要测量的数据是 。
 (3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
(3)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。
②实验时放出气体的总体积是 mL。
③放出 气体所需时间为
min。
气体所需时间为
min。
④反应放出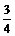 气体所需时间约为
min。
气体所需时间约为
min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑥解释反应速率变化的原因 。
⑦ 计算H2O2的初始物质的量浓度_____________mol/L。 (请保留两位有效数字)
25、工业制硝酸的主要反应是:
4NH3(g)+5O2(g) 4NO(g)+6H2O (g)+Q;Q =1025 kJ·mol-1
(1)该反应的平衡常数表达式为K=________________;升高温度K值__________ (填“增大”、“减小”或“不变”)。
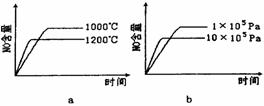
(2)若反应物起始的物质的量相同,下列关系图错误的是________ (填序号)。

(3)在容积固定的密闭容器中发生上述反应,容器内部分物质的物质的量浓度如下表:
|
时间/浓度 |
c(NH3)(mol/L) |
C(O2)(mol/L) |
C(NO)(mol/L) |
|
起始 |
0.8 |
1.6 |
0 |
|
第2min |
0.6 |
a |
0.2 |
|
第4min |
0.3 |
0.975 |
0.5 |
|
第6min |
0.3 |
0.975 |
0.5 |
|
第8min |
0.8 |
1.6 |
0.5 |
①起始时物料比c (O2):c (NH3)>1.25,其原因是____________________________。
②反应在第2min到第4min时O2的平均反应速率为______________ mol/L·min;
③反应在第2min改变了反应条件,改变的条件可能是 ________ (填序号)
a.使用催化剂 b.升高温度 c.增大压强 d.增加O2的浓度
④反应在第8min改变的反应条件可能是___________________________________。
24、某反应体系中,有反应物和生成物六种物质:HCl(浓)、KClO3、KCl、ClO2、Cl2、H2O。已知该反应中,KClO3发生了一个过程:KClO3→ClO2。ClO2是黄绿色易爆的气体。
(1) 写出并配平上述过程的化学方程式,并标出电子转移的方向和数目。
_____________________________________________________________
(2) 该反应中,盐酸体现了_______、_______性质。氧化剂是___________,反应后,若产生0.6mol气体,则转移电子的物质的量为___________mol。
(3) ClO2是一种广谱型的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合,并加H2SO4反应制得,在以上反应中,NaClO3和Na2SO3的物质的量之比为_________
23、下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
|
族 周期 |
IA |
|
0 |
|||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
|
|
|
② |
③ |
④ |
|
|
|
3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)④、⑤、⑥的原子半径由大到小的顺序为[填元素符号]_______________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是[填化学式]________________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
(4) 由②和④组成,且②和④的质量比为3∶8的化合物的结构式是 ,
其中含________键,(填“极性”或“非极性”下同)属于________分子
该物质与⑤的同周期相邻主族元素的单质反应的化学方程式为 __
(5) ⑥单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
22、向200mL 0.5mol/L的稀硝酸溶液中加入0.54克铝粉,放出448mL(S.T.P)NO气体,经充分反应,向所得溶液中加入0.5mol/LNaOH溶液,生成0.78沉淀。加入氢氧化钠溶液的体积可能是( )
A.100mL B.150 mL C.180 mL D.200 mL
第II卷(非选择题,共84分)
21、有机物甲发生银镜反应,甲催化加氢还原成有机物乙,1mol乙跟足量的金属钠反应放出标准状况下氢气22.4L,据此推断乙一定不是 ( )
A.HOCH2CH2OH B.HOCH2CH(OH)CH3
C.CH3CH2CH2OH D.CH3CH(OH)CH(OH)CH3
20、在25mL0.1mol∙L-1 NaOH溶液中逐滴加入0.1mol∙L-1 CH3COOH溶液,曲线如右图所示,有关粒子浓度关系正确的是 ( )
A.在A、B间任一点,溶液中一定都有c(Na+)+c(H+)=c(CH3COO-)+(OH-)
 B.在B点,a<25,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
B.在B点,a<25,且有c(Na+)=c(CH3COO-)>c(OH-)=c(H+)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在D点:c(CH3COO-)+c(CH3COOH)=c(Na+)
19、下列图象能正确表示相关反应中产物物质的量的变化的是(横、纵坐标单位:mol)
A.图1:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敞口容器中生成的气体
B.图2:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐
C.图3:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物
D.图4:n(HNO3)=1mol,Fe和稀HNO3反应生成的氧化产物(还原产物为NO)

18、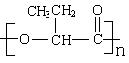 PHB塑料是一种在微生物的作用下可降解的环保型塑料,
PHB塑料是一种在微生物的作用下可降解的环保型塑料,
其结构简式如右图所示,下面有关PHB说法错误的是( )
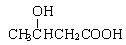 A.PHB是一种聚酯 B.PHB的降解产物可能有CO2和H2O
A.PHB是一种聚酯 B.PHB的降解产物可能有CO2和H2O
C.PHB的单体是 D.PHB可通过加聚反应制得
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com