
28.(10北京试测)(14分)次氯酸钠和高铁酸钾(K2FeO4)是两种重要的化工产品,在生产和生活中有广泛的应用。
(1)工业上用氯气和烧碱溶液可以制取次氯酸钠,反应的离子方程式是 。
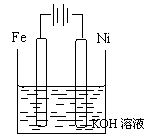 (2)工业上有多种方法制备高铁酸钾。
(2)工业上有多种方法制备高铁酸钾。
①电解法:原理如右图所示。阴极的电极反应是 。
②湿法氧化:在溶液中用次氯酸钠、氢氧化铁和氢氧化钾制高铁酸钾,
参加反应的氧化剂和还原剂的物质的量之比是 。
 (3)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2
(3)已知:4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2
4FeO42-+20H+=4Fe3++3O2↑+10H2O
①配制高铁酸钾溶液时,应将其溶于一定浓度的KOH溶液中,原因是
 。
。
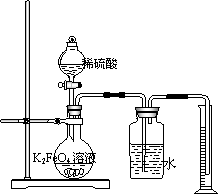
②用如图所示装置测定高铁酸钾溶液中溶质的物质的量浓度,需要
测定的两个实验数据是 。
(4)用高铁酸钾和锌制成高铁碱性电池,能储存比普通碱性电池
多50%的电能,已知该电池的总反应是:
2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,则负极的电极反应是
。
答案:(1)Cl2+2OH-=Cl-+ClO-+H2O。(2)2H2O+2e-=H2↑+2OH-
或2H++2e-=H2↑。(3)①抑制FeO42-的水解,阻止FeO42-与酸反应。②K2FeO4溶液的体积、量筒中水的体积(O2的体积)。(4)3Zn+10OH-OHOH-6e-=ZnO+2ZnO22-+5H2O。
考点:常见无机物(Cl2)性质;电解原理(电极反应式书写)、原电池原理应用(化学电源中电极反应式书写);氧化还原(守恒计算);化学平衡(浓度对平衡的影响);实验方案设计(数据采集与处理)。
12.理论综合
25.(10东城零模)(16分)已知0.1mol有机物A的质量是12g,在足量的氧气中充分燃烧后生成0.8molCO2和7.2gH2;A可以发生银镜反应,其苯环上的一卤代物有三种。
(1)A的分子式是 ,A中含氧官能团的名称是 ,A的结构简式为
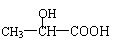
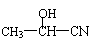
 。
。
|
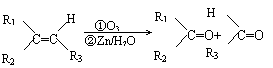 Ⅱ.
Ⅱ.
现有如下转化关系:

其中D能使溴的四氯化碳溶液褪色,F继续被氧化生成G,G的相对分子质量为90。
(2)C可能具有的化学性质有 (填序号)。
①能与H2发生加成反应
②能在碱性溶液中发生水解反应
③能与甲酸发生酯化反应
④能与Ag(NH3)2OH溶液发生银镜反应
(3)①C→D的化学方程式是 ;
②一定条件下,D生成高聚物的化学方程式是 ;
③G与NaHCO3溶液反应的化学方程式是 ;
(4)向盛有5mLG的饱和溶液的试管中滴入有稀硫酸酸化的KMnO4溶液,振荡,观察到的现象是KMnO4溶液褪色,说明G具有 性。
(5)C的同分异构体有多种,其中符合下列要求的有机物有两种:
①属于酯类化合物 ②加饱和溴水产生白色沉淀 ③与新制的氢氧化铜共热可生成红色沉淀 ④苯环上的一卤代物只有一种
写出其中一种有机物的结构简式: 。
 答案:(1)C8H8O 醛基
(2)①③
答案:(1)C8H8O 醛基
(2)①③
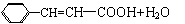 (3)①
(3)①
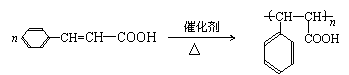
②
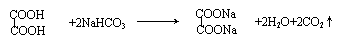 ③
③

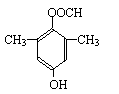 (4)还原
(4)还原
(5)
或 (任写一个均得分)
25.(10海淀零模)(16分)有机物F、G是常见的塑料,可通过下图所示的路线合成:
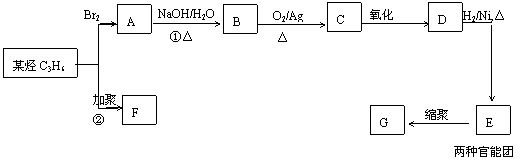
(1)有机物B中的含氧官能团是 。
(2)高分子化合物G的结构简式是 。
(3)反应①的化学方程式是 。
 (4)反应②的化学方程式是
。
(4)反应②的化学方程式是
。
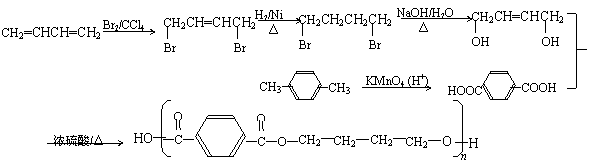
(5)PBT( )是一种重要的工程塑料。
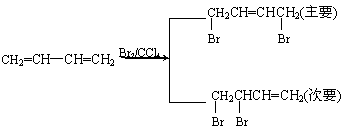
已知:①

②
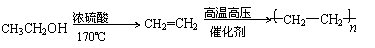

|
示例:
合成PBT的反应流程图为: 。
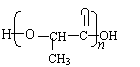
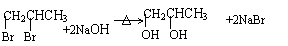 答案:(1)羟基
(2)
(3)
答案:(1)羟基
(2)
(3)
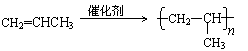 (4)
(4)
 (5)
(5)
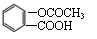 (10西城零模)25.(14分)有机物A是合成解热镇痛药阿司匹林(
)和治疗溃疡药奥沙拉嗪钠(C14H8O6N2Na2)的原料。
(10西城零模)25.(14分)有机物A是合成解热镇痛药阿司匹林(
)和治疗溃疡药奥沙拉嗪钠(C14H8O6N2Na2)的原料。
(1)实验室用A和乙酸酐[化学式为(CH3CO)2O]反应合成阿司匹林。
①由A合成阿司匹林反应的化学方程式是 。
②反应结束时,可用于检验A是否转化完全的试剂是 ;可用于检测产物阿司匹林含有的官能团的物理方法是 。

 (2)由A合成奥沙拉嗪钠的路线如下图所示:
(2)由A合成奥沙拉嗪钠的路线如下图所示:
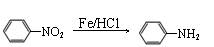
 已知:I
已知:I
II
①C含有的官能团名称是 。
②D可能发生反应的反应类型是 。
a.取代反应 b.加成反应 c.消去反应 d.氧化反应
③E的分子结构对称,其核磁共振氢谱具有5个吸收峰,则奥沙拉嗪钠的结构简式是 。
④符合下列条件的B的同分异构体J有 种。
a.J分子内苯环上有2个取代基,且能发生水解反应和银镜反应
b.1 mol J与足量的Na反应生成0.5 mol H2

答案:(1)①
②(2分)饱和溴水或FeCl3溶液 (2分)测其红外光谱
(2)①(2分)羟基、酯基和硝基; ②(2分)abd
②(2分)abd
③(2分)
④(2分)6 (以下两种结构邻位、间位和对位共6种同分异构体)
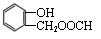
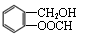
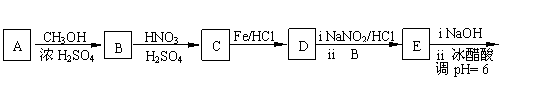
25.(10北京试测)(14分)有机化合物D常用于香料工业和电镀工业。D的合成过程如图所示:
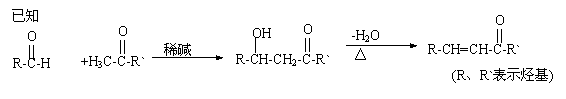
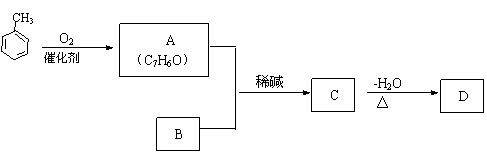
(1)①A中含氧官能团的名称是 。
②A可以发生的反应是 (填字母)。
A.还原反应 b.消去反应 c.水解反应 d.取代反应
(2)B是由碳、氢、氧三种元素组成的化合物,经质谱分析相对分子质量为58;分子中含有碳氧双键和2个甲基。B的结构简式 。
(3)D的结构简式是 。
(4)已知B能和H2发生加成反应;E与C互为同分异构体。A氧化后的产物与B和H2加成后的产物在一定条件下反应制得E,该反应的化学方程式 。
(5)F可作塑料热稳定剂,由苯酚和B反应制得:
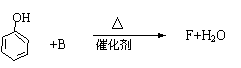
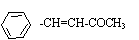 F能与NaOH反应,F分子苯环上的一氯取代产物只有两种,核磁共振氢谱显示其分子中含有4种不同类型的氢原子。F的结构简式是
。
F能与NaOH反应,F分子苯环上的一氯取代产物只有两种,核磁共振氢谱显示其分子中含有4种不同类型的氢原子。F的结构简式是
。
答案:(1)①醛基 ②ad (2)CH3COCH3 (3)
 (4)
(4)

(5)
有机考点:有机推断。有机信息的获取与应用。
官能团的识别(含氧官能团如醛基、羟基与羧基、碳碳双键)与特性;反应类型、结构简式、化学方程式;核磁共振氢谱与等到效氢原子用于结构的推断与验证等。
11.有机综合
8.(10东城零模)下列是某同学对相应反应的离子方程式所作的评价,其中合理的是
|
编号 |
化学反应 |
离子方程式 |
评价 |
|
A |
碳酸钙与醋酸反应 |
CO32-+2CH3COOH= CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解质,不应写成离子形式 |
|
B |
苯酚钠溶液中通入CO2 |
2C6H5O-+CO2+H2O= CO32-+C6H5OH |
正确 |
|
C |
NaHSO3溶液的水解 |
 HSO3+H2O SO32-+H3O+ HSO3+H2O SO32-+H3O+ |
错误,水解方程式写电离方程式 |
|
D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2= 2Fe3++Br2+4Cl- |
错误,Fe2+与Br-的物质的量之比与化学式不符 |
8.(10北京试测)在指定溶液中,下列各组离子一定能大量共存的是
A.pH=1的溶液:Fe2+、Mg2+、NO3-、SO42-
B.由水电离出的c(H+)=1×10-13 mol•.L-1的溶液:HCO3-、K+、SO42-、Cl-
C.含大量Fe3+的溶液:NH4+、Na+、SCN-、Cl-
D.pH=13的溶液:Na+、K+、AlO2-、CO32-
考点:H++NO3-与Fe2+的氧化还原反应。c(H+)w=1×10-13 mol•.L-1的溶液是酸、或碱溶液;HCO3-与H+或OH-的反应。Fe3+与SCN-的反应。
10.离子反应与离子方程式
9.(10北京试测)下列说法正确的是
A.0.1mol 1H37Cl分子中含有的中子数为2×6.02×1023
B.0.05mol NH3分子中含有的共价键数为0.5×6.02×1023
C.0.3mol Cu完全溶解在浓硫酸中,转移电子数为0.3×6.02×1023
D.常温下,42g乙烯和丁烯的混合气体中含有的碳原子数为2×6.02×1023
考点:ZAX的含义及两个恒等式。简单分子中共价键数目。铜与浓硫酸反应(与反应进程相关)的有关计算。共同规律(最简式相同,元素组成相同)。
(10海淀零模) 8.已知反应:H2(g)+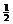 O2(g)=H2O(g) △H1
O2(g)=H2O(g) △H1
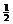 N2(g)+O2(g)=NO2(g) △H2
N2(g)+O2(g)=NO2(g) △H2
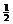 N2(g)+
N2(g)+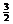 H2(g)=NH3(g) △H3
H2(g)=NH3(g) △H3
则反应2NH3(g)+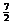 O2(g)=2NO2(g)+3H2O(g) 的△H为
O2(g)=2NO2(g)+3H2O(g) 的△H为
A.2△H1+2△H2-2△H3 B.△H1+△H2-△H3
C.3△H1+2△H2+2△H3 D.3△H1+2△H2-2△H3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com