
16、下列离子方程式中正确的是
A、溴化亚铁溶液中通入过量氯气: 3Cl2 + 2Fe2+ + 4Br- = 6Cl- + 2Fe3+ + 2Br2
B、过量CO2通入偏铝酸钠溶液中: CO2 + 2H2O + AlO2- = Al(OH)3↓+ HCO3-
C、在溶液中亚硫酸氢铵与等物质的量的氢氧化钠混合:
NH4+ + HSO3- +2OH- = SO32- + NH3↑+2H2O
D、碳酸氢镁溶液中加入过量石灰水:Mg2+ +2HCO3- +Ca2+ +2OH- =CaCO3↓+2H2O +MgCO3↓
15、氢化钠(NaH)是一种白色离子晶体,其中钠是+1价,NaH与水反应放出H2,下列叙述中正确的是
A、NaH在水中显酸性; B、NaH中氢离子的电子层排布与氦原子相同
C、NaH中氢离子半径比锂离子半径小; D、NaH中氢离子可被还原成H2
14、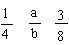 将amol纯铁粉投入含HNO3bmol的稀溶液中,恰好完全反应并放出NO气体,则a和b的关系为
将amol纯铁粉投入含HNO3bmol的稀溶液中,恰好完全反应并放出NO气体,则a和b的关系为
A、a:b=1:4 B、a:b=3:8 C、 ≤ ≤ D、无法确定
13、下列实验事实中能用勒沙特列原理来解释的是
A、往硫化氢水溶液中加碱有利于S2-的生成; B、加催化剂有利于氨氧化的反应
C、高压不利于合成氨的反应; D、500℃左右比室温更有利于合成氨的反应
12、已知一种[H+]=1×10-3mol/L的酸和一种[OH-]=1×10-3mol/L的碱溶液等体积混和后,溶液呈酸性。其原因可能是
A、浓的强酸与稀的强碱溶液反应 B、浓的弱酸和稀的强碱溶液反应
C、等浓度的强酸和弱碱溶液反应; D、生成了一种弱酸强碱盐
11、不能用水浴加热的实验是
A、苯的硝化反应 B、银镜反应 C、制酚醛树脂 D、由乙醇制乙烯
10、用铂电极电解硫酸铜溶液,当溶液中Cu2+浓度降至一定范围时,需加入适量的物质。如果要使加入物质后溶液的浓度和体积恢复到电解前的状况,所加入的物质可以是
A、Cu(OH)2 B、CuSO4·5H2O C、CuO D、CuCO3
9、在固定体积的密闭容器中,一定温度下,加入2molBr2和1molH2发生反应:H2(g) + Br2(g)
 2HBr 达到平衡时,HBr的质量分数为W%;要相同条件下,按下列情况充入物质,达到平衡时,HBr的质量分数仍为W%的是
2HBr 达到平衡时,HBr的质量分数为W%;要相同条件下,按下列情况充入物质,达到平衡时,HBr的质量分数仍为W%的是
A、2molHBr B、3molHBr C、4molBr2 + 2molH2 D、1molBr2 + 2molHBr
8、 将固体NH4I置于密闭的容器中,在某温度下发生反应:NH4I(s) NH3(g) + HI(g);2HI(g)
将固体NH4I置于密闭的容器中,在某温度下发生反应:NH4I(s) NH3(g) + HI(g);2HI(g)
 H2(g) + I2(g)
当反应达到平衡时,[H2]=0.5mol/L ,[HI]=4mol/L,则NH3的浓度为
H2(g) + I2(g)
当反应达到平衡时,[H2]=0.5mol/L ,[HI]=4mol/L,则NH3的浓度为
A、3.5mol/L B、4mol/L C、4.5mol/L D、5mol/L
7、某饱和一元醛发生银镜反应时,生成了21.6gAg,将等质量的该醛完全燃烧可生成26.4gCO2,则该醛为
A、丙醛 B、丁醛 C、己醛 D、乙醛
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com