
1. 物体做曲线运动的条件
当物体所受的合外力方向与速度方向不在同一直线上时,物体做曲线运动。合运动与分运动具有等时性、独立性和等效性。
22.(11分)由c、H、O三种元素组成的有机物A、B、c、D、E,它们具有如图所示的转化关系:
已知:①A的相对分子质量为86,C的相对分子质量为44;

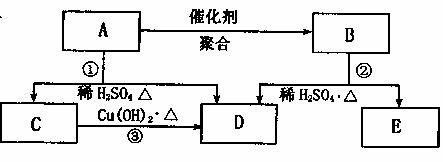 ②RCH=CHOH(烯醇)不稳定,很快异构成RCHCHO;
②RCH=CHOH(烯醇)不稳定,很快异构成RCHCHO;
根据上述信息回答下列问题:
(1)A的分子式: ;
(2)反应①的化学方程式: ;
(3)C中的官能团名称: ;
(4)A有多种同分异构体,写出三个同时满足:
①能发生水解;②能使Br2的CCl4褪色
两个条件的同分异构体的结构简式: ;
(5)写出反应③的反应方程式: ;
反应③的反应类型是 。
21.(7分)由短周期元素组成的物质A-K,它们之间具有下图的转化关系:(图中反应条件已省略)
已知:A是常见金属;
B是常见非金属单质,常温为固体,其颜色常呈黑色或无色;
E、F为常见气体,混合时点燃发生爆炸。

(1)写出:构成物质A的原子结构示意图: ;D的电子式: ;K的俗名: ;
(2)写出反应①各物质恰好完全反应的化学方程式: ;
(3)反应②中,若B和F按物质的量之比为4:3恰好完全反应,则生成物物质的量之比n(G):n(H) ;
20.(8分)V、W、X、Y、Z五种短周期元素,原子序数依次增大,在周期表中,W、Z属同一主族;X分别与W、Y相邻;V与W,V与Z均可形成原子个数比为4:l的共价化合物。请回答下列问题:
(1)下列比较不正确的是: ;
A.原子半径:Z>W>X>Y>V;
C.沸点:V2Y>XV3>WV4;
B.稳定性:WV4>ZV4;
D.熔点:WY2>ZY2;
(2)WX一与X2属等电子体(微粒电子数相同,结构也相似),则WX一的电子式为: ;
(3)X与Z组成化合物ZnXb熔点高,硬度大,且每个原子皆达到8电子结构,则化合物ZnXb的化学式为: ;其晶体熔化时,所破坏的微粒间相互作用是: ;
(4)工业 上用W单质与ZY2在高温下,按物质的量之比为3:1反应,写出该反应的化学方程式:
;
上用W单质与ZY2在高温下,按物质的量之比为3:1反应,写出该反应的化学方程式:
;
(5)由WV4与Y2、KOH构成燃料电池,放电时,正极区的pH变化是: (填“升高”,“降低”或“不变”)
19.(9分)某溶液仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
|
阳离子 |
Na+ Mg2+ Fe3+ Al3+ Fe2+ |
|
阴离子 |
OH- CO32- Cl- NO3- SO42- |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,溶液中阴离子种类不变;
请推断:
(1)原溶液中含有阳离子:  ;含有阴离子: ;
;含有阴离子: ;
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式: ;
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为 g。
18.(9分)在恒温恒容的密闭容器中通入lmoIN2和XmolH2,发生如下反应:

|
 N2(g)+3H2(g)
2NH3(g)
N2(g)+3H2(g)
2NH3(g)
已知:①反应过程能量变化如右图;②达到平衡
时,测得反应放 出的热量为18.4KJ,混合气体
出的热量为18.4KJ,混合气体
物质的量为3.6moL,容器内压强减小10%;
请回答下列问题:
(1)图中A点表示 ;C点表示
;
(2)该反应通常使用铁为主体的复合催化剂,使
用该催化剂时,B点的变化是
(填“升高”或“降低”)
(3)X值为 ;
(4)该反应的热化学方程为 ;
(5)若起始时充入的N2、H2、NH3物质的量分别为a、b、c,平衡时各组分的量与上述平衡均相等,且始终维持反 应向正方向进行,则起始时c的取值范围为 。
应向正方向进行,则起始时c的取值范围为 。
17.(8分)[I](3分)下列有关仪器的名称、图形、用途及使用操作的叙述均正确的是:
|
|
A |
B |
C |
D |
|
名称 |
250ml容量瓶 |
分液漏斗 |
酸式滴定管 |
温度计(量程150℃) |
|
图形 |
 |
 |
 |
 |
|
用途与操作 |
配制1.0mol/LNaCl溶液定容时仰视刻度配得溶液浓度/1.0mol/L。 |
用苯萃取碘水中碘分液时,油层需从上口放出。 |
可用于量取10.00mL的酸性KMnO4溶液。 |
用于实验室制乙烯时。插入反应液控制所需温度。 |
|
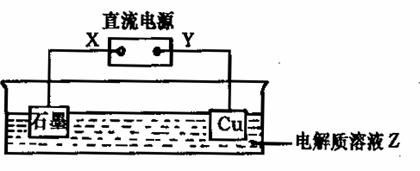
电解池示意图如下:
请回答下列问题:
(1)直流电源X极名称: ;
(2)石墨电极的电极反应式为 ;
(3)Cu2O应在 极附近生成,根据 现象可确定Cu2O已开始生成;
(4)电解溶液应选用:(填序号) ;
A.H2SO4 B.HCl C.KOH D.NaOH
16.将15.6gdNa2O2与8.4g晶体si同时投入一定量水中,充分反应后,~200mE,再向溶液中缓缓通入6.72L标准状况下HCl气体,若反应过程溶液体积不变,则下列叙述正确的是 ( )
A.根据硅元素守恒,生成沉淀23.4g
B.所得溶液pH<7
C.根据钠元素守恒,溶液中NaCI物质的量浓度为2mol/L
D.所得溶液c(Na+)>e(C l一)+2e(SiO32-)+c(HsiO3-)
第Ⅱ卷(非选择题,共52分)
15.I、Ⅱ、Ⅲ、Ⅳ是某活动小组研究可逆反应:
 X2(g)+3Y2(g) 2XY3(g);
X2(g)+3Y2(g) 2XY3(g); △H<O
△H<O
在一容积可变的密闭容器中控制某一条件时的图像

有关图像分析正确的是 (  )
)
A.图像I是研究不同压强条件下,X2的转化率
B.图像Ⅱ是研究t0时使用正催化剂,正逆反应速率均加快
C.图像Ⅲ是t0时,在恒温条件下,充入nmolX2气体且使体积增大(n-2)L,n>2时速率的变化
 D.图像Ⅳ是研究不同温度条件下,Y2的浓度变化
D.图像Ⅳ是研究不同温度条件下,Y2的浓度变化
14.常温下甲为pH=2的醋酸溶液;乙为pH=2的醋酸和盐酸的混合液,等体积的甲乙两溶液相比,下列说法正确的是 ( )
A.乙溶液中c(OH一)小于甲溶液中c(OH一)
B.甲溶液中c(CH3COO一)一定大于乙溶液中c(CH3COO一)
C.乙溶液 离子浓度大小关系为:c(Cl一)>c(CH3COO一)>c(H+)>c(OH一)
离子浓度大小关系为:c(Cl一)>c(CH3COO一)>c(H+)>c(OH一)
D.加入相同浓度的NaOH溶液至中性,甲、乙两溶液消耗NaOH溶液的体积相同
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com