
19.(14分)异噁草酮是一种色素抑制类除草剂,它的工业合成路线如下:
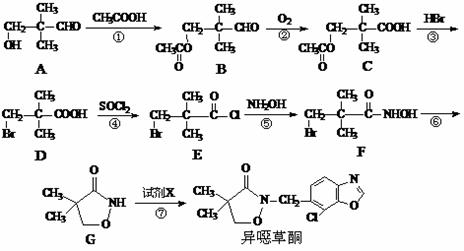
⑴从A→D过程中,反应①的目的是 ▲ 。
⑵写出满足下列条件的A的一种同分异构体的结构简式 ▲ 。
①与A具有相同的官能团;②分子中具有两个手性碳原子。
⑶物质D与NaOH溶液反应的化学方程式为 ▲ 。
⑷由G制备异噁草酮的反应中要加入试剂X(C8H5NOCl2),X的结构简式为 ▲ 。
⑸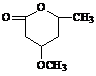 是B的一种重要的同分异构体。请设计合理方案,完成从
是B的一种重要的同分异构体。请设计合理方案,完成从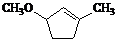 到
到 的合成路线(用合成路线流程图表示,并注明反应条件)。
的合成路线(用合成路线流程图表示,并注明反应条件)。

 ……
……
提示:①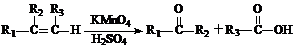 ;
;
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
CH3CH2OH CH2=CH2
CH2=CH2
 CH2-CH2
CH2-CH2
18.(8分)在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
⑴已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ/mol
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ/mol
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ/mol
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= ▲ 。
⑵某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果。


①实验过程中除空燃比不同外,其他条件:汽车尾气的流速、 ▲ 等必须相同。
②在一定条件下,测得尾气中的主要污染物的转化率与空燃比的关系如右图所示。空燃比约为 ▲ 时,催化剂对汽车尾气的催化效果最好。
⑶CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。
下列说法错误的是 ▲ 。
 A.负极的电极反应式为:CO+O2-―2e-=CO2
A.负极的电极反应式为:CO+O2-―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中CO的含量越高
17.(10分)利用化学原理可以对工厂排放的废水进行有效检测与合理处理。
⑴染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水,会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO2-的离子方程式为 ▲ 。
⑵废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7 mol/L时,溶液中c(PO43-)= ▲ mol/L。
(已知Ksp[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石―鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能为 ▲ 。与方法一相比,方法二的优点为 ▲ 。
⑶三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
CCl2=CHCl +·Cl→·CCl2CHCl2
·CCl2CHCl2 + O2→·OOCCl2CHCl2
·OOCCl2CHCl2→·OCCl2CHCl2 + 1/2O2
·OCCl2CHCl2→CHCl2COCl +·Cl
该反应的总化学反应为 ▲ 。
16.(12分)一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高。其主要流程如下:
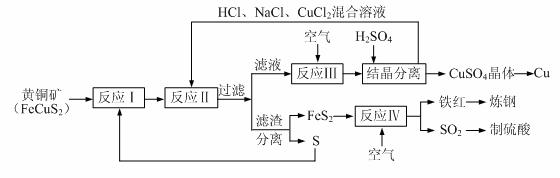
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
请回答下列问题:
⑴反应Ⅰ的产物为(填化学式) ▲ 。
⑵反应Ⅲ的离子方程式为 ▲ 。
⑶一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
▲ 。
⑷炼钢时,可将铁红投入熔融的生铁中,该过程中主要反应的化学方程式是 ▲ 。
⑸某硫酸厂为测定反应Ⅳ所得气体中SO2的体积分数,取280mL(已折算成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:Cr2O72-+ Fe2++ H+→Cr3++ Fe3++ H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为 ▲ 。
②反应Ⅳ所得气体中SO2的体积分数为 ▲ 。
15.(12分)CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
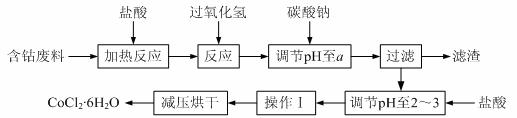
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
7.6 |
3.4 |
|
完全沉淀 |
4.1 |
9.7 |
9.2 |
5.2 |
请回答下列问题:
⑴在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 ▲ 。
⑵加入碳酸钠调节pH至a,a的范围是 ▲ 。
⑶操作Ⅰ包含3个基本实验操作,它们是 ▲ 和过滤。
⑷制得的CoCl2·6H2O需减压烘干的原因是 ▲ 。
⑸为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 ▲ 。
⑹在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是 ▲ 。
14.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况)。下列说法正确的是
A.原混合溶液中c(K+)为2 mol/L B.上述电解过程中共转移4 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为4mol/L
13. 在其他条件不变时,改变某一条件对A2(g)+3B2(g)
在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度)。下列结论正确的是
2AB3(g)化学平衡状态的影响,得到如右图所示的变化规律(图中T表示温度)。下列结论正确的是
A.a、c两点A2的转化率相等
B.正反应一定是吸热反应,且T2>T1
C.b点时,平衡体系中A、B原子数之比为1:3
D.向a点的平衡体系中加入A2,可达到b点的平衡状态
12.下列溶液中各微粒的浓度关系正确的是
A.等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+)
B.0.1 mol/L pH=9的NaNO2溶液中:c(Na+)>c(NO2-)>c(OH-) >c(H+)
C.向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)= c(HCO3-)+2c(CO32-)
D.将10 mL 0.1 mol/LNa2CO3溶液逐滴滴加到10 mL 0.1 mol/L盐酸中:
c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
11.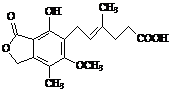 麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示。下列有关麦考酚酸说法正确的是
麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示。下列有关麦考酚酸说法正确的是
A.分子式为C17H22O6
B.不能与FeCl3溶液发生显色反应
C.在一定条件下可发生加成、取代、消去反应
D.1 mol麦考酚酸最多能与3 mol NaOH反应
10.下列说法中正确的是
A.Na的金属性比Mg强,故可用Na与MgCl2溶液反应制取金属Mg
B.明矾[KAl(SO4)2·12H2O]在水中能形成Al(OH)3胶体,可用作净水剂
C.BaCl2溶液能使含酚酞的Na2CO3溶液红色褪去,其原因是BaCl2溶液呈酸性
D.硬水含有Ca2+、Mg2+、HCO3-、SO42-,煮沸可以完全除去其中的Ca2+、Mg2+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com