
5. ⑴0.02 mol/L; c ( B) ·[c( C)]2/ [c( A)]3 ⑵ 增大 (3)0.004mol/L·s ;
 (4)a b (2分) (5) 3A (g)
(4)a b (2分) (5) 3A (g)  2C(g) + B(g)-100akJ
2C(g) + B(g)-100akJ
5. 向某密闭容器中加人 0.15mol/LA 、 0.05mol/LC 和一定量的 B 三种气体。一定条件下发生反应,各物质浓度随时间变化如下图中甲图所示[t0 时c( B) 未画出, t1时增大到0.05mol/L]。乙图为 t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。

(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为___mol/L;
该反应的平衡常数表达式为K= 。
 (2)若t5时改变的条件是升温,此时v(正) > v(逆), 平衡常数K的值将__(选填“增大”、“减小”或“不变”)。
(2)若t5时改变的条件是升温,此时v(正) > v(逆), 平衡常数K的值将__(选填“增大”、“减小”或“不变”)。
(3)若 t1= 15 s ,则t0~ t1阶段以C 浓度变化表示的平均反应速率为v(C)=____mol/L· s。
(4) t3 时改变的某一反应条件可能是 (选填序号)。
a使用催化剂 b增大压强 c增大反应物浓度
(5)若A 的物质的量减少 0 . 03 mol时,容器与外界的热交换总量为 akJ ,写出该反应的热化学方程式___________________。
4. 在容积为VK的密闭容器中发生2NO2
在容积为VK的密闭容器中发生2NO2 2NO+O2的反应。反应过程中NO2的物质的量 随时间变化的状况如图所示。(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是( )
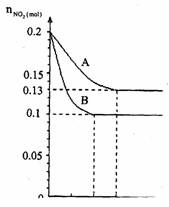
A.有、无催化剂
B.温度不同
C.压强不同
D.V值不同
(2)写出该反应的化学平衡常数K的表
达式 ,并比较
K800℃ K850℃(填>、<或=)。
(3)在图上作出在A条件下NO的变化曲线,并求算在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
(4)不能说明该反应已达到平衡状态的是 ( )
A.V正(NO2)=V逆(NO) B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变 D.气体的密度保持不变
 4.
答案.(1)B
4.
答案.(1)B
 (2)
(2) <
<
(3)
(4)BD
第(4)题2分,VO2 2分,
其余各1分,共8分。

3. 答案
(1)吸热(1分),逆向(1分);
(2)C2H5OH(g) → C2H4(g) + H2O(g) – 46KJ(1分)
(3)K=(1分), a、b;(2分)
(4)大于(1分),150~175℃(1分)。
3. 乙醇脱水反应在不同温度条件下得到的产物组成不同。下表是常压、某催化剂存在条件下,分别以等量乙醇在不同温度下进行脱水实验获得的数据,每次实验反应时间均相同。


已知:乙醇和乙醚(CH3CH2OCH2CH3)的沸点分别为78.4℃和34.5℃。试分析:
 (1)乙醇脱水制乙烯的反应是________(填“放热”、“吸热”)反应,若增大压强,平衡_____________(选填“正向”、“逆向”、“不”)移动;
(1)乙醇脱水制乙烯的反应是________(填“放热”、“吸热”)反应,若增大压强,平衡_____________(选填“正向”、“逆向”、“不”)移动;
(2)已知:150℃时,1mol乙醇蒸汽脱水转变为1mol乙烯,反应热的数值为46KJ,写出该反应的热化学方程式____________________________________;
(3)写出乙醇脱水制乙醚的反应的平衡常数表达式________________。当乙醇起始浓度相同时,平衡常数K值越大,表明 (填序号);
a.乙醇的转化率越高 b.反应进行得越完全
c.达到平衡时乙醇的浓度越大 d.化学反应速率越快
(4)根据表中数据分析,150℃时乙醇催化脱水制取的乙醚产量______(选填“大于”、“小于”、“等于”)125℃时;为了又快又多地得到产品,乙醇制乙醚合适的反应温度区域是______。
2.(1)否 (1分) AB (2分) (2)C (1分) (3)D(1分)
(4)= (2分) (5)10-13或1.0×10-13 (1分)
(6)12 (2分)
2. I .图为向25mL 0.1 mol·L-1 NaOH溶液中逐滴滴加0.2 mol·L-1 CH3COOH溶液过程中溶液pH的变化曲线。请回答:

(1)B点溶液呈中性,有人据此认为,在B点时NaOH与CH3COOH恰好完全反应,这种看法是否正确? (1分)(选填“是”或“否”)。若不正确,则二者恰好完全反应的点是在AB区间还是BD区间内? 区间(若正确,此问不答)(2分)
(2)关于该滴定实验,从下列选项中选出最恰当的一项 。(选填字母)(1分)


(3)AB区间,c(OH-)>c(H+),则c(OH-)与c(CH3COO-)大小关系
是 (1分)
A.c(OH-)一定大于c(CH3COO-)
B.c(OH-)一定小于c(CH3COO-)
C.c(OH-)一定等于c(CH3COO-)
D.c(OH-)大于、小于或等于c(CH3COO-)
(4)在D点时,溶液中c(CH3COO-)+c(CH3COOH) 2c(Na+)。
(填“>”、“<”或“=”)(2分)
II.t℃时,某稀硫酸溶液中c(H+)=10-a mol·L-1,c(OH-)=10-b mol·L-1,已知
a+b=13 :
(5)该温度下水的离子积常数K w的数值为 。(1分)
 (6)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的
(6)该温度下(t℃),将100mL 0.1 mol·L-1的稀H2SO4溶液与100mL 0.4 mol·L-1的
NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。(2分)
1. I.(1)90%(1分)5670L·mol-1(2分,漏掉或写错单位扣1分)
Ⅱ.(1)2C2H6(g)+7 O2(g)=4CO2(g)+6H2O (l) △H=-3116.6KJ·mol-1(2分)
C2H6+18 OH― → 2CO32― +12H2O+14e- [或C2H6+14 OH― → 2CO2+10H2O+14e-](2分)
(3)4 OH― →2 H2O +O2↑+4e-(1分)氧化铜 4g [或碳酸铜 6.2g或氧化亚铜7.2g](2分)
1. I.如下图所示,将2molA气体和1molB气体充入一容积可变的密闭容器中。
 发生反应:2A(g)+B(g)
发生反应:2A(g)+B(g) 2C(g)。反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,A的转化率为________________;
2C(g)。反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,A的转化率为________________;
该条件下反应的平衡常数为_______________________________。

Ⅱ.(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,放出热量1558.3KJ。写出该反应的化学方程式__________________________________________.
(20利用该反应设计一个燃料电池:用氢氧化钾溶液做电解 质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气。写出负极的电极反应式____________________________
 (3)有如图是化学实验装置图,
(3)有如图是化学实验装置图,

石墨棒上的电极反应式为_______________________________;
如果起始时盛有1000mLpH=5的硫酸铜溶液(25℃)(CuSO4 足量),一段时间后溶液的pH变为1,若要使溶液恢复到起始浓度(忽略溶液体积的变化),可向溶液中加入________(填物质名称),其质量为_______________.
19、嘉园超市每天晚上10∶00停止营业,届时需广播提醒顾客。请你代写一则广播稿,准备在晚上9∶30播出,用以提醒顾客。(10分)
要求:语言得体,亲切自然,80字左右。
福建省龙岩市09-10学年高一上学期期末教学质量检查
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com