
0.5molH2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ
[错误分析]本题有的同学对燃烧热、中和热的概念搞不清容易误选B或者C
[正确解答]燃烧热:在101 k Pa时1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量。
中和热:在稀溶液中,强酸和强碱发生中和反应生成1mol水时的反应热。
[答案]本题的正确选项为C
13.材料科学是近年来与化学有关的科学研究的重点,某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化等特性。它是以中学化学中的常见物质为原料来生产的。下图所示为其生产过程,其中虚线框内转化是为探究C的组成而设。已知A、B均为非金属单质,G、F、H均为难溶于水的白色沉淀;图中除D、K(均含A元素)外均为中学化学常见物质。
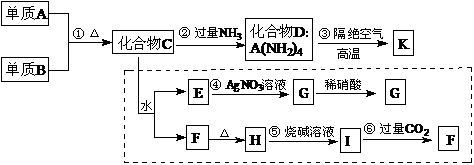
请回答下列问题:
⑴指出K所属的晶体类型 。
⑵写出化学式:单质B ,化合物F 。
⑶写出反应③的化学方程式____________________ 。
12.聚合硫酸铁硫酸铁(PFS)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铁的氧化物为原料来制取PFS,为控制水解时Fe3+的浓度,防止生成氢氧化铁沉淀,原料中的Fe3+必须先还原为Fe2+。生产步骤如下:
 (1)步骤I能否用HCl代替H2SO4 ?
(填“能”或“不能”)。
(1)步骤I能否用HCl代替H2SO4 ?
(填“能”或“不能”)。
(2)步骤II取样分析溶液中的Fe2+、Fe3+的含量,目的是 。
(3)步骤III所用的还原剂是 。
(4)步骤IV用NaClO3或 HNO3氧化时反应方程式(注意均未配平)如下:
FeSO4 + NaClO3 + H2SO4 → Fe2(SO4)3 + NaCl + H2O
FeSO4 + HNO3 + H2SO4 → Fe2(SO4)3 + NO↑ + H2O
已知1mol HNO3价格0.16元、1mol NaClO3价格0.45元,评价用HNO3代替NaClO3作氧化剂的利弊是 。
(5)产品PFS溶液中SO42-与Fe3+物质的量之比不是3:2。步骤V先加入NaOH溶液和 BaCl2溶液,目的是测定产品中SO42-与Fe3+物质的量之比。测定时需要称量 和 的质量。
11、已知H2O2、KMnO4、NaClO、K2Cr2O7均有强氧化性,将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的PH分别为6.4、6.4、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:

请回答下列问题:
(1)本实验最适合的氧化剂X是 ;
A、K2Cr2O7 B、NaClO C、H2O2 D、KMnO4
(2)物质Y可能是 ;
(3)除去Fe3+的有关化学方程式是 、 ;
(4)加氧化剂的目的是 ;
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O ,若能应如何操作 。
10、氢叠氮酸(HN3)与醋酸的酸性相近,其盐稳定,但受撞击时会发生爆炸,生成氮气。关于把叠氮酸有以下说法:①NaN3水溶液呈碱性;②HN3固体属于分子晶体;③固体NaN3属于离子晶体;④NaN3可用于小汽车防撞保护气囊。其中正确的是
A、①②③ B、①②③④ C、②③④ D、①③④
9、氢化铵(NH4H)与氯化铵的结构相似,已知氢化铵与水反应有氢气产生,下列叙述不正确的是
A、NH4H是离子化合物,含离子键、共价键
B、NH4H溶于水,所形成的溶液显酸性
C、NH4H与水反应时,是还原剂
D、将固体NH4H投入少量水中,有两种气体产生
8、在氯化钡溶液中通入二氧化硫,溶液仍澄清,若将氯化钡溶液分装两支试管,一支加硝酸,另一支加氢氧化钠溶液,然后再通入二氧化硫,结果两支试管中都有白色沉淀生成。由此得出下列结论合理的是
A、氯化钡有两性 B、两支试管中的白色沉淀都是硫酸钡
C、二氧化硫具有还原性和酸性 D、升高PH使二氧化硫水溶液中SO32-浓度增大
7、不同的卤素原子间可以通过共用电子对形成卤素互化物,其通式为XX‘n(n=1,3,5,7),这种互化物绝大多数不稳定,易发生水解反应。已知BrFn和水反应时物质的量之为3:5,其产物为溴酸、氢氟酸、溴单质和氧气,试判断下列说法正确的是
A、此卤素互化物为BrF5 B、此卤素互化物为BrF5
C、每1molBrFn完全反应,可生成1molBr2和1molO2
D、BrFn的许多性质类似于卤素单质,有很强的还原性
6、50克含有1.17克氯化钠和0.84克氟化钠的溶液中加入过量的硝酸银溶液,充分搅拌、静置、过滤、洗涤、干燥,称量得到2.87克固体,由此可得出的正确结论是
A、氯离子全部参加了反应 B、氟离子只有一部分参加反应
C、氟化银难溶于水 D、氟化钠和硝酸银在溶液中无沉淀生成
5、由于碘是卤素中原子半径较大的元素,可能呈金属性。下列事实能够说明这个结论的是
A、已经制得了ICl、IBr等卤素互化物
B、已经制得了I2O5等碘的氧化物
C、已经制得了I(NO3)3、I(CLO4)32H2O等I3+离子的化合物
D、碘易溶于KI等碘化物溶液,形成I3-离子
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com