
25、我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料制得NaHCO3,进而生产出纯碱。以下A、B、C、D四个装置可组装成实验室模拟“侯氏制碱法”制取NaHCO3的实验装置。装置中分别盛有以下试剂:B:稀硫酸C:盐酸、碳酸钙D:含氨的饱和食盐水、水

A B C D
四种盐在不同温度下的溶解度(g/100g水)表
|
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
||||
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
||||
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
||||
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
||||
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
(说明:①>35℃NH4HCO3会有分解)
请回答以下问题:
⑴装置的连接顺序应是_______________(填字母)。
⑵A装置中盛放的试剂是_____,其作用是_____________________。
⑶在实验过程中,需要控制D温度在30℃-35℃,原因是_______________。为了便于控制此温度范围,采取的加热方法为___________。
⑷反应结束后,将锥形瓶浸在冷水中,析出NaHCO3晶体的原因是_______。用蒸馏水洗涤NaHCO3晶体的目的是除去______________杂质(以化学式表示)
⑸将锥形瓶中的产物过滤后,所得的母液中含有_____(以化学式表示),可加入氯化氢,并进行_______操作,使NaCl溶液循环使用,同时可回收NH4Cl。
⑹测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32―+H+=HCO3―反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=______________。
24、(1)有右下图所示A、B、C、D四种仪器:请选择下列仪器名称的序号,填人相
应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管
A ______ B____ C______D_______
(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可
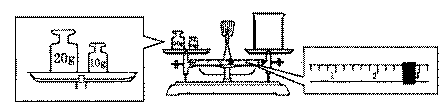 以看出,该学在操作时的一个错误是______________,烧杯的实际质量为_____g.
以看出,该学在操作时的一个错误是______________,烧杯的实际质量为_____g.
(3)指出下面3个实验中各存在的一个错误:

A.__________;B___________;C_________________。
23、已知:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。有两个实验小组的同学决定通过实验探究碱石灰的组成。
(1)第一小组设计方案的流程如下:
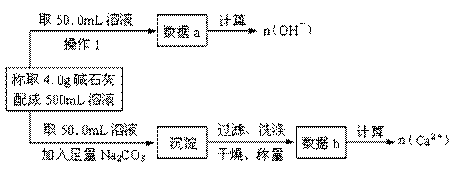
①写出n (OH-)、n (Ca2+)与n (Na+)的关系:n(Na+)= 。
②设n (Na+)=x mol、n (Ca2+)=y mol,请填写下表:
|
碱石灰的 可能组成 |
NaOH、CaO |
NaOH、CaO、 Ca (OH)2 |
NaOH、 Ca (OH)2 |
NaOH、 Ca (OH)2、H2O |
|
n (Na+)、n
(Ca2+) 的关系 |
40x+56y = 4 |
|
|
|
(2)第二小组同学查得如下资料:Ca(OH)2在250℃时不分解、NaOH在580℃时不分解。
他们设计了如下方案并得出相关数据:取市售碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.42g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.75g。请通过计算确定该碱石灰中各成分的质量分数。
22、 如右图所示,B中盛装的是一种固体物质。当A中的溶液滴入B内反应一段时间后,所得产物经装置C后可得到纯净的气体X,每个X分子中含有10个电子。D中盛装的是黑色粉末,当X气体通过D时,黑色粉末逐渐变成红色,最后从E装置中出来的气体是一种纯净的单质Y,Y在标准状况下的密度为1.25g/L。装置中A、B、C、D、E中的药品只能从下列所给试剂a~p中选择,图中某些夹持仪器未画出。
如右图所示,B中盛装的是一种固体物质。当A中的溶液滴入B内反应一段时间后,所得产物经装置C后可得到纯净的气体X,每个X分子中含有10个电子。D中盛装的是黑色粉末,当X气体通过D时,黑色粉末逐渐变成红色,最后从E装置中出来的气体是一种纯净的单质Y,Y在标准状况下的密度为1.25g/L。装置中A、B、C、D、E中的药品只能从下列所给试剂a~p中选择,图中某些夹持仪器未画出。
a.浓硫酸 b.浓硝酸 c.稀硝酸 d.浓盐酸 e.稀硫酸 f.浓氨水
g.铜片 h.锌片 i.碱石灰 j.硫酸铜 k.生石灰 l.硝酸铵晶体
m.固体烧碱 n.稀NaOH溶液 o.CuO p.MnO2
回答下列问题:
⑴C装置内的药品是 (用a~p中的字母表示),其作用是 。
⑵A中溶液和B中固体的所有可能的组合共有 种。
⑶纯净气体X通过D时,发生反应的化学方程式是 ,反应中若转移电子的物质的量为1.2mol,则D装置中黑色固体共失重 g。
⑷E中的药品是 (用a~p中的字母表示),其作用是 。
21、某固体混合物可能含有MgCO3、Al2(SO4)3、Na2SO4、Ba(NO3)2、AgNO3和CuSO4。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”):
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(2)取溶液进行焰色反应,火焰呈黄色;
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
|
肯定存在的物质 |
肯定不存在的物质 |
理由 |
|
|
|
|
(4)通过上述实验仍无法确定的物质是______________。
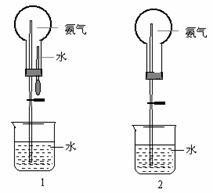
20、制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气前化学方程式: 。
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂。
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 。该实验的原理是 。
(4)如果只提供如图2的装置,请说明引发喷泉的方法
19、可以用来发生、洗涤、干燥、收集(不考虑尾气
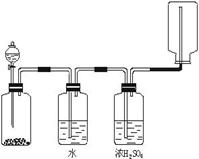 处理)气体。该装置可用于( )
处理)气体。该装置可用于( )
A. 锌和盐酸生成氢气
B. 二氧化锰和浓盐酸生成氯气
C. 碳酸钙和盐酸生成二氧化碳
D. 氯化钠和浓硫酸生成氯化氢
18、下列实验设计能够成功的是( )
|
|
|
|
|
|
检验Na2O2试样是否变质为Na2CO3 |
向试样中加入盐酸,产生无色无味的气体 |
|
|
检验某卤代烃是否是氯代烃 |
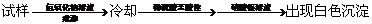 |
|
|
证明酸性条件H2O2氧化性比I2强 |
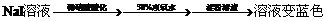 |
|
|
证明醋酸是弱酸 |
取醋酸钠固体加水溶解,测其pH值,pH>7 |
17、用石灰水、小苏打、淀粉和食醋等不能完成的实验是( )
A.碘盐中碘的检验 B.暖瓶中水垢的除去C.食盐和纯碱的鉴别 D.鸡蛋壳主要成分的检验

16、关于某溶液所含离子检验的方法和结论正确的是( )
A.加入一定量的NaOH溶液,有白色沉淀生成,则原溶液一定有Mg2+
B. 加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失则原溶液一定有Cl-
C.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中可能有CO32-或SO32-
D.加入NaOH并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液是铵盐溶液。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com