
下表是广东省1980-2006年户籍总人口和主要农产品产量变化统计表,据表格回答10-11题。
|
|
1980年 |
1990年 |
2000年 |
2006年 |
|
户籍总人口(单位:万人) |
5193.28 |
6299.94 |
7298.88 |
8048.71 |
|
稻谷产量(单位:万吨) |
1523.92 |
1687.00 |
1528.53 |
1104.30 |
|
糖蔗产量(单位:万吨) |
834.73 |
2093.46 |
1137.59 |
1123.64 |
|
水果产量(单位:万吨) |
29.10 |
328.58 |
643.52 |
89.3.47 |
10.以下说法正确的是 ( )
A.户籍总人口数量增长速度一直逐渐变快
B.1990-2006年水果产量增长了1倍
C.1990-2006年糖蔗产量持续增长
D.1990-2006年稻谷总产量和人均稻谷产量都呈下降趋势
11.造成表中稻谷产量变化的主要原因可能是 ( )
A.农村劳动力大量的流失 B.产业结构的调整
C.气候条件的恶化 D.生产成本的提高
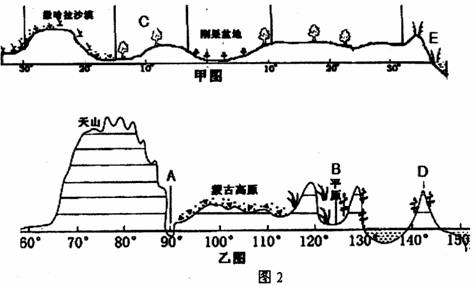
7.经线x与纬线y分别是 ( )
A. 0°与38°N B. 20°E与43°N
C. 20°W与30°N D. 40°W与50°N
8.关于图中自然带下列说法不正确的是 ( )
A. 表示热带稀树草原带
表示热带稀树草原带
B. 表示亚热带常绿硬叶林带
表示亚热带常绿硬叶林带
C.甲图自然带分布体现了从赤道向两极的地域分异规律
D.甲乙两图中的荒漠带自然环境均是由于深居大陆内部海洋水汽难以到达所致
9.当甲图中C区域草木枯黄时 ( )
A.A处成为所在国高温中心 B.B处小麦正值收割忙季
C.E处气候温和湿润 D.D岛西侧山坡多雪
4.图示区域内,最高处与最低处的相对高度可能为 ( )
A.360米 B.390米 C.480米 D.520米
5.图示区域位于 ( )
A.北半球 B.南半球 C.热带 D.温带
6.a、b两地的温差约为 ( )
A.0.3℃ B.1℃ C.1.8℃ D.2℃
1.据图判断,C在A的方向 ( )
A.西北 B.东北
C.东南 D.西南
2.若P的经度为145°,此日P地的昼长约为 ( )
A.8小时 B.10小时
C.14小时 D.16小时
3.下列四幅图能正确反映此时世界各地地理现象的是 ( )


本部分共35题,每题4分,共140分。在每题给出的四个选项中,只有一项是最符合题目要求的。

22.(7分)现有由等质量的NaHCO3和KHCO3组成的混合物a g与100ml盐酸反应。(题中涉及的气体体积均以标准状况计,填空时可用带字母的式子表示,可不化简)
(1)该混合物中NaHCO3和KHCO3的物质的量之比为________
(2)如果碳酸氢盐与盐酸恰好完全反应,则盐酸中的HCl的物质的量为______mol
(3)如果盐酸过量,生成CO2的体积是_____________L。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量,要计算生成CO2的体积,还需要知道___。
21.(6分)(1)配平下列反应的化学方程式(假定NO与NO2的物质的量之比为1:3)





 Fe + HNO3 = Fe(NO3)3 + NO↑+ NO2↑+ H2O
Fe + HNO3 = Fe(NO3)3 + NO↑+ NO2↑+ H2O
(2)此反应配平时可以有多组系数,其原因是_____________________________________
(3)请简述检验溶液中的金属阳离子的实验操作及现象________________________
20.(12分)A.B.C.D.E、F、G、H、I、J均为有机化合物,根据以下框图,回答问题:

(1)B和C均为有支链`的有机化合物,B的结构式为___________ ;C在浓硫酸作用下加热反应只能生成一种烯烃D,D的结构简式为_____________。
(2)G能发生银镜反应,也能使溴的四氯化碳溶液褪色,则G的结构简式为________
(3)写出⑤的化学反应方程式_____________。⑨的化学反应方程式________________。
(4)①的反应类型__________,④的反应类型__________,⑦的反应类型__________。
(5)与H具有相同官能团的H的同分异构体的结构简式为____________________。
19.(12分)物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)

(1)第一种情况:A为气体;用两根玻璃棒分别蘸取 A.G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:
① B与甲反应的化学方程式为_________________________________________。
② D与乙反应的离子方程式为________________________________________。
(2)第二种情况:A为黄色固体;甲可由两种单质直接化合得到; D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
① 工业上,反应 I 在___________________(填设备名称)中进行。
② 甲的化学式为______________。
③ D和乙反应的离子方程式为_________________________________________。
④ 请简述检验G溶液中阴离子的方法_____________________________________
⑤ 若A的相对分子质量为M,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=________(列出计算式即可)。
18.(12分)短周期元素W、X、Y、Z、在元素周期表中的位置如图所示,
|
W |
|
|
|
|
|
|
|
|
|
|
|
X |
Y |
Z |
|
|
其中X、Y、Z三种元素的质子数之和为21。
(1)W与Z形成原子个数比为1∶1的化合物,其电子式为___________ 。
(2)Y的最高价氧化物对应的水化物与Y的氢化物恰好完全反应,生成物的水溶液呈酸性,其原因是 _____________________________________(用化学用语表示);该溶液中各种离子浓度由大到小的顺序为_______________________________。
(3)由X W4、Z2和KOH溶液组成的新型燃料电池中,负极上发生反应的电极反应式为___________________________________________________。
 (4)已知:2YZ2(g)
(4)已知:2YZ2(g)  Y2Z4(g);△H<0。在恒温恒容条件下,将一定量XZ2和X2Z4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如右图所示。
Y2Z4(g);△H<0。在恒温恒容条件下,将一定量XZ2和X2Z4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如右图所示。
① A.B.C.d四个点中,化学反应
处于平衡状态的是___________点。
② 25 min时,增加了___________
(填物质的化学式)________mol。
③ a、b、c、d四个点中所表示的反应
体系中,气体颜色由深到浅的顺序是
________(填字母)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com