
29.(12分)过氧化氢是一种重要的化工原料,它具有氧化性、还原性、不稳定性和弱酸性。
(1)废旧印刷电路板经粉碎处理,分离得到金属粉末和非金属粉末。控制其他条件相同,将金属粉末用10% H2O2和3.0mol·L-1 H2SO4混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜的平均溶解速率 (×10-3mol·L-1 ·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是________________________________________________________________。
(2)在酸性条件下,过氧化氢可以氧化Fe2+;过氧化氢也可以被Fe3+氧化。通过改变反应途径,Fe2+和H+实际对H2O2的分解起着催化剂的作用。试用离子方程式表示Fe2+和H+对H2O2分解反应的催化过程________________________________;__________________________。
(3)下列试剂能够证明过氧化氢具有还原性的是________________(填序号)。
①酸性高锰酸钾溶液 ②KI溶液 ③亚硫酸溶液 ④Ba(OH)2溶液
(4)将H2O2溶液逐滴加入含有酚酞的NaOH溶液中,红色消失。甲同学认为是由于H2O2是弱酸性,消耗OH-,而使红色褪去;乙同学认为是由于H2O2具有强氧化性,将酚酞氧化,而使红色褪去。请设计一个实验验证甲、乙同学的解释谁正确,简述实验方案______________________________________________________________________________________________________。
28.(15分)运用化学反应原理研究碳的氧化物的性质具有重要意义。
(1)CO2是一种重要的物质,但其过量排放,可能导致全球气温升高。下列措施不能够有效控制CO2所导致的温室效应的是_________(填序号)
①大力发展低碳产业,提倡低碳生活,依法控制CO2的过量排放
②禁止滥砍滥伐,植树造林,恢复生态
③开发利用各种新型能源代替煤、石油、天然气等化石能源
④提倡使用脱硫煤、无铅汽油等清洁燃料
(2)常温下,碳酸在水中的电离常数Ka1=4.2×10-7 ,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka =4.7×10-8。写出84消毒液露置在空气中发生反应的离子方程式__________________________
__________________________。
(3)CO具有还原性,某同学设计图示装置(固定装置及胶管略去)验证CO气体能否与Na2O2反应。

|
已知:H2C2O4====== CO2↑+CO↑+H2O,则实验选择的最简单的装置接口连接顺序为________;
若CO能够与Na2O2发生反应,则预测反应产物为____________。实验后用球形干燥管中的固体进行验证可选择的试剂是_______________________________。
(4)已知C(s)+O2(g)=CO2(g),△H=-393.5
kJ·mol -1 ;CO(g)+ O2(g)=CO2(g),△H=-283.0
kJ·mol -1,写出CO2 和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
O2(g)=CO2(g),△H=-283.0
kJ·mol -1,写出CO2 和C(s)反应的热化学方程式_____________________________________。以CO为燃料制作燃料电池,电池的正极通入O2和CO2,负极通入CO,电解质是熔融碳酸盐,放电时负极反应式为______________________。若使用该电池电解饱和食盐水制取1molNaClO,则理论上需要氧气的体积为(标准状况下)________L。
27.(16分)自然界中,多数动物的性别决定属于XY型,而鸡属于ZW型(雄:ZZ,雌:ZW)。鸡具有一些易观察的性状,且不同相对性状之间的差别明显,易于分辨,因此常作为遗传研究的实验材料。下面是一组关于鸡的某些性状的遗传研究,请分析回答:
(1)鸡冠的形状是由位于不同对的常染色体上的两对等位基因A、a和R、r决定,有四种类型,胡桃冠(A_R_)、豌豆冠(A_rr)、玫瑰冠(aaR_)和单冠(aarr)。
①两亲本杂交,子代鸡冠有四种形状,比例为3:3:1:1,且非玫瑰冠鸡占5/8,则两亲本的基因型是____
____________。
②让纯合的豌豆冠鸡和玫瑰冠鸡杂交,子一代的雌雄个体自由交配,F2代与亲本鸡冠形状不同的个体中,杂合体占的比例为_________________。
③某养鸡户的鸡群中没有玫瑰冠个体,而另外三种鸡冠雌雄个体都有,欲通过一代杂交获得尽可能多的玫瑰冠鸡,最好选择基因型为___________________的两种亲本杂交。
(2)鸡的羽毛有芦花和非芦花两种,由另一对染色体上的一对等位基因控制,芦花(B)对非芦花(b)是显性。芦花鸡羽毛在雏鸡阶段的绒羽为黑色且头顶有黄色斑点。若欲确定B、b基因的位置,可选择纯合的芦花雌鸡和非芦花雄鸡杂交。
①若F1代表现型为__________________,则可以肯定B、b基因位于Z染色体的非同源区段(即W染色体上没有与之等位的基因)上。
②若F1代全为芦花鸡,则B、b基因位于______________。若欲再通过一代杂交作进一步的判断,其最简单的方法是_______________。
③假设实验已确定B、b基因位于Z染色体的非同源区段上。现有一蛋用鸡养殖场为了降低饲养成本,提高经济效益,在他们扩大养殖规模时,请你告诉他们-种亲本配种的方法及筛选的措施,以实现他们的愿望。
亲本的基因型:________________。筛选措施:____________________。
(3)近几年,鸡禽流感在全球蔓延,注射流感疫苗成了预防流感的重要措施之一,流感疫苗作用的原理是___
____________________。试利用放射性同位素标记法探究:禽流感病毒的遗传物质是DNA还是RNA?请简述该实验的设计思路:___________________________。
26.(17分)某学校生物课外小组的同学用完全培养液培养了一批长势相同的大豆幼苗,并以这些大豆幼苗为实验材料,做了一系列的实验。请根据下列具体实验情况回答相关问题:
(1)取30株大豆幼苗随机均分成A、B两组放到完全培养液中培养,随后又对两组幼苗分别进行了如下处理:A组添加高浓度的KNO3溶液;B组注射“呼吸阻断剂”。A组植株根尖成熟区细胞可能发生 现象;B组植株对K+的吸收量会受到严重影响,其原因是______________。一个成熟的植物细胞中,相当于半透膜的结构是________________。
(2)将数量不等的大豆植株幼苗随机移栽到 5 块面积和土壤肥力都相同的地块,每一地块内的植株分布是均匀的,待成熟后,统计数据如下表:
|
地块号 |
1号 |
2号 |
3号 |
4号 |
5号 |
|
地块植株数 |
20 |
40 |
60 |
80 |
100 |
|
荚果数/植株数 |
8.3 |
6.8 |
3.9 |
2.7 |
2.1 |
|
每个荚果中种子数 |
3.0 |
2.9 |
3.2 |
2.9 |
3.0 |
①请用生态学原理解释“地块植株数”、“荚果数/植株数”两个统计项目中数据产生变化的原因 。
②通过对表中数据分析,你能得出的结论是 。
③如果要全面调查了解5 地块的物种多样性(微生物除外),除要调查地面上的植物、动物种类以外,还应进行___________________的调查。
(3)取50株大豆幼苗随机均分成甲、乙两组,分别种植于不同的地块中。一段时间后,甲组叶片出现发黄现象,乙组叶片生长正常。为了查明原因,同学们运用课本中的相关实验进行了探究,最后证明:甲组叶片发黄是由于叶绿素含量减少所致。请你根据下列要求,把同学们的实验设计补充完整。
①实验原理:略
②实验步骤:(简要叙述操作过程即可)
a选取甲组适量发黄叶片、乙组相同部位相同质量的正常叶片;
b_____________________________________________________;
c_____________________________________________________;
d_____________________________________________________。
③预期实验结果:__________________________________________。
25. (18分)如图甲所示,P、Q为水平面内平行放置的金属长直导轨,间距为d,处在大小为B、方向竖直向下的匀强磁场中.一根质量为m、电阻为r的导体棒ef垂直于P、Q放在导轨上,导体棒ef与P、Q导轨之间的动摩擦因数为μ.质量为M的正方形金属框abcd,边长为L,每边电阻均为r,用细线悬挂在竖直平面内,ab边水平,线框的a、b两点通过细导线与导轨相连,金属框上半部分处在大小为B、方向垂直框面向里的匀强磁场中,下半部分处在大小也为B,方向垂直框面向外的匀强磁场中,不计其余电阻和细导线对a、b点的作用力.现用一电动机以恒定功率沿导轨方向水平牵引导体棒ef向左运动,从导体棒开始运动计时,悬挂线框的细线拉力T随时间的变化如图乙所示,求:
(18分)如图甲所示,P、Q为水平面内平行放置的金属长直导轨,间距为d,处在大小为B、方向竖直向下的匀强磁场中.一根质量为m、电阻为r的导体棒ef垂直于P、Q放在导轨上,导体棒ef与P、Q导轨之间的动摩擦因数为μ.质量为M的正方形金属框abcd,边长为L,每边电阻均为r,用细线悬挂在竖直平面内,ab边水平,线框的a、b两点通过细导线与导轨相连,金属框上半部分处在大小为B、方向垂直框面向里的匀强磁场中,下半部分处在大小也为B,方向垂直框面向外的匀强磁场中,不计其余电阻和细导线对a、b点的作用力.现用一电动机以恒定功率沿导轨方向水平牵引导体棒ef向左运动,从导体棒开始运动计时,悬挂线框的细线拉力T随时间的变化如图乙所示,求:
(1)t0时间以后通过ab边的电流
(2)t0时间以后导体棒ef运动的速度
(3)电动机的牵引力功率P
24. (15分)一电动小车沿如图所示的路径运动,小车从A点由静止出发,沿粗糙的水平直轨道运动L后,由B点进入半径为R的光滑竖直圆形轨道,运动一周后又从B点离开圆轨道进入水平光滑轨道BC段,在C与平面D间是一蓄水池.已知小车质量m=0.1kg、L=10m、R=0.32m、h=1.25m、s=1.50m,在AB段所受阻力为0.3N.小车只在AB路段可以施加牵引力,牵引力的功率为P=1.5W,其他路段电动机关闭.问:要使小车能够顺利通过圆形轨道的最高点且能落在右侧平台D上,小车电动机至少工作多长时间?(g取10m/s2)
(15分)一电动小车沿如图所示的路径运动,小车从A点由静止出发,沿粗糙的水平直轨道运动L后,由B点进入半径为R的光滑竖直圆形轨道,运动一周后又从B点离开圆轨道进入水平光滑轨道BC段,在C与平面D间是一蓄水池.已知小车质量m=0.1kg、L=10m、R=0.32m、h=1.25m、s=1.50m,在AB段所受阻力为0.3N.小车只在AB路段可以施加牵引力,牵引力的功率为P=1.5W,其他路段电动机关闭.问:要使小车能够顺利通过圆形轨道的最高点且能落在右侧平台D上,小车电动机至少工作多长时间?(g取10m/s2)
23.(12分)请完成以下两个小题
(1)在“描绘小灯泡的伏安特性曲线”实验中.用导线a、b、c、d、e、f、g、h按图所示方式连接电路,电路中所有元器件都完好.
①合上开关后,若电压表的示数为2 V,电流表的指针有微小偏转,小灯泡不亮,则一定断路的导线为_______.
 ②合上开关后,若反复调节滑动变阻器,小灯泡亮度发生变化,但电压表、电流表的示数不能调为零,则断路的导线为________.
②合上开关后,若反复调节滑动变阻器,小灯泡亮度发生变化,但电压表、电流表的示数不能调为零,则断路的导线为________.
③请在图中虚线框内画出实验原理图
(2)某实验小组利用如图甲所示的实验装置来验证钩码和滑块所组成的系统机械能守恒.图乙所示是用游标卡尺测量遮光条的宽度,其读数为d= cm;实验时将滑块从图示位置由静止释放,由数字计时器读出遮光条通过光电门的时间Δt=1.2×10-2s,则滑块经过光电门时的瞬时速度为 m/s.在本实验中,为了验证系统的机械能是否守恒,需要测量的物理量除了钩码的质量外,还需要测量 和 .

22.如图所示,边长为L的等边三角形ABC为两有界匀强磁场的理想边界,三角形内的磁场方向垂直纸面向外,磁感应强度大小为B,三角形外的磁场(足够大)方向垂直纸面向里,磁感应强度大小也为B.把粒子源放在顶点A处,它将沿∠A的角平分线发射质量为m、电荷量为q、初速度为v0的带负电的粒子(粒子重力不计).则下列说法正确的是
 A.若v0=
A.若v0= ,则粒子第一次到达C点所用的时间为
,则粒子第一次到达C点所用的时间为
B.若v0= ,则粒子第一次到达C点所用的时间为
,则粒子第一次到达C点所用的时间为
C.若v0= ,则粒子第一次到达B点所用的时间为
,则粒子第一次到达B点所用的时间为
D.若v0= ,则粒子第一次到达B点所用的时间为
,则粒子第一次到达B点所用的时间为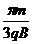
第Ⅱ卷(必做120分+选做32分,共152分)
[必做部分]
21. 如图所示,空间存在相互垂直的匀强电场和匀强磁场,电场的方向竖直向下,磁场方向水平(图中垂直纸面向里),一带电油滴P恰好处于静止状态,则下列说法正确的是
如图所示,空间存在相互垂直的匀强电场和匀强磁场,电场的方向竖直向下,磁场方向水平(图中垂直纸面向里),一带电油滴P恰好处于静止状态,则下列说法正确的是
A.若仅撤去电场,P可能做匀加速直线运动
B.若仅撤去磁场,P可能做匀加速直线运动
C.若给P一初速度,P可能做匀速直线运动
D.若给P一初速度,P可能做逆时针方向的匀速圆周运动
20.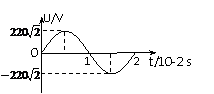 某变压器原、副线圈匝数比为55:9,原线圈所接电源电压按图示规律变化,副线圈接有负载.下列判断正确的是
某变压器原、副线圈匝数比为55:9,原线圈所接电源电压按图示规律变化,副线圈接有负载.下列判断正确的是
A.输出电压的最大值为36V
B.原、副线圈中电流之比为55:9
C.变压器输入、输出功率之比为55:9
D.变压器输入电压有效值为220V,频率为50Hz
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com