
13.下列事实中,能用勒夏特列原理来解释的是( )
A.加入催化剂有利于氨的氧化反应
B.溴水中有下列平衡Br2+H2O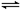 HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
C.对2HI(g) H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
D.合成NH3反应,采取500℃的高温措施
12.在一定条件下,恒容容器中加入NO2,反应2NO2(g)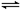 O2(g)+2NO(g) (正反应吸热) 达平衡。X、Y表示不同的物理量,其中Y随X的变化不符合图中曲线的是
O2(g)+2NO(g) (正反应吸热) 达平衡。X、Y表示不同的物理量,其中Y随X的变化不符合图中曲线的是

A.当X表示温度时,Y表示NO2的物质的量
B.当X表示压强时,Y表示NO2的转化率
C.当X表示反应时间时,Y表示混合气体的密度
D.当X表示NO2的物质的量时,Y表示O2的物质的量含量
11.T℃、1.01×106Pa,某密闭容器内,A(g)+B(g)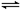 3C达平衡,此时c(A)=0.022mol/L;压强增大到2.02 ×106Pa,第二次达平衡时,c(A)=0.05mol/L;若压强增大到4.04×106Pa,第三次达到平衡时,c(A)=0.075mol/L。则下列关于C物质状态的推测正确的是
3C达平衡,此时c(A)=0.022mol/L;压强增大到2.02 ×106Pa,第二次达平衡时,c(A)=0.05mol/L;若压强增大到4.04×106Pa,第三次达到平衡时,c(A)=0.075mol/L。则下列关于C物质状态的推测正确的是
A.C为非气态 B.C为气态
C.第二次达到平衡时C为非气态 D.第三次达到平衡时C为非气态
10.右图曲线是在其他条件一定时反应2NO(g)+O2(g)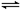 2NO2(g)(正反应放热) 中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态且v(正)>v(逆)的点是
2NO2(g)(正反应放热) 中NO的最大转化率与温度的关系。图上标有A、B、C、D、E五点,其中表示未达到平衡状态且v(正)>v(逆)的点是

A.A或E B.C点 C.B点 D.D点
9.一定温度下,在体积为 VL 的密闭容器中加入1molX和1molY进行如下反应:
X(g)+ Y(g)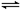 2Z(g)+ W(s)(正反应吸热) 达到平衡,下列判断正确的是( )
2Z(g)+ W(s)(正反应吸热) 达到平衡,下列判断正确的是( )
A.向平衡混合物中加入少量W,逆反应速率增大
B.温度不变,将容器的体积变为0.5VL,Z的物质的量含量变比原来的低
C.温度不变,将容器的体积变为2VL,Z的物质的量浓度变为原来的1/2
D.当容器中混合气体的压强不变时,可以证明此反应已达到平衡状态
8.下图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或者增大压强,速率的变化都符合的示意图的反应是

A.2SO2(g)+O2(g)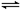 2SO3(g) (正反应放热)
2SO3(g) (正反应放热)
B.4NH3(g)+5O2(g)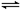 4NO(g)+6H2O(g) (正反应放热)
4NO(g)+6H2O(g) (正反应放热)
C.H2(g)+I2(g)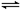 2HI(g) (正反应吸热) D.2NH3(g)
2HI(g) (正反应吸热) D.2NH3(g)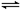 N2(g)+3H2(g) (正反应吸热)
N2(g)+3H2(g) (正反应吸热)
7.在一个不传热的固定容积的密闭容器中可逆反应mA(g)+nB(g)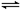 pC(g)+qQ(g),当m、n、p、q为任意整数时,达到平衡的标志是:
pC(g)+qQ(g),当m、n、p、q为任意整数时,达到平衡的标志是:
①体系的压强不再改变 ②体系的温度不再改变
③各组分的浓度不再改变 ④各组分的质量分数不再改变
⑤v(A):v(B):v(C):v(D)=m:n:p:q ⑥单位时间内m mol A断键,同时p mol C断键
A.②③④⑤⑥ B.②③④⑥ C.①②③④⑤⑥ D.①③④⑥
6.在一定容积的密闭容器中进行SO2和O2的反应,下列措施能使反应速率增大的是
①提高反应温度 ②使用催化剂 ③充入空气 ④充入氮气 ⑤减小容器体积
A.只有②③⑤ B.只有①②⑤ C.除④外全部 D.全部
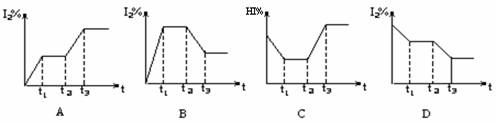
5.在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g)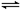 H2(g)+I2(g),(正反应吸热)。在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
H2(g)+I2(g),(正反应吸热)。在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
4.在373K时,把0.5 molN2O4气体通入体积为5L的真空密闭容器中,立即出现棕色。反应进行到2s时,NO2的浓度为0.02 mol/L。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是
A.前2s,以N2O4的浓度变化表示的平均反应速度为0.01 mol/(L·s)
B.在2s时体系内的压强为开始时的1.4倍 C.在平衡时体系内含N2O40.25 mol
D.平衡时,如果压缩容器体积,则可降低N2O4的转化率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com