
33.在一个容积固定的反应器中,有一可左右滑动的密封隔板,两侧分别进行如图所示的可逆反应。各物质的起始加入量如下:A、B均为5.0mol、C为6.5mol、D为8.5mol、F为4.0mol,设E为xmol。当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置。请填写以下空白:
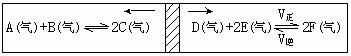
(1)若x=5.5,则右侧反应在起始时间 (填“正反应”或“逆反应”)方向进行。
(2)欲使开始时V(正)>V(逆),x的取值范围为 ;V(正)<V(逆),x的取值范围为 。
(3)若x分别为5.5和7.0,则在这两种情况下,反应达平衡时,A物质的量是否相等? (填“相等”、“不相等”或“不能确定”)。其理由是
。
32.A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的气球。关闭K2,将等量且少量的NO2通过K1、K3分别充人A、B中,反应起始时,A、B的体积相同。已知:
2NO2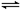 N2O4(反应放热)
N2O4(反应放热)
(1)一段时间后,反应达到平衡,此时A、B中生成的N2O4的速率是VA_________VB。(填“>”、“<”、“=”);若打开活塞K2,气球B将________(填“变大”、“变小”、“不变”)。
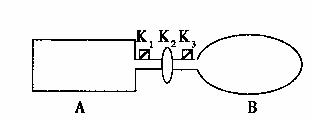
(2)若A、B中再充人与初始量相等的NO2,则达平衡时,NO2的转化率αA将 ,αB将 (填“增大”或“减小”、“不变”);若通人等量Ne气,则达平衡时,A中NO2转化率将 ,B中NO2转化率将 (填“变大”、“变小”、“不变”)。
(3)室温下,若A、B都保持体积不变,反应前将A套上一个绝热层,B与外界可以进行热传递,则达到平衡时,_________中的颜色较深。
(4)若在容器A、B中各充人4.6g的NO2,容器A、B的体积均为VL。达到平衡后容器B内混合气体的平均相对分子质量为57.5,则平衡时B中N2O4的物质的量为 。打开K2,反应重新达平衡后,B的体积为 。
(5)为使两者NO2在平衡混合物中物质的量浓度相同,下列措施可行的是
A.向B中再充人一定量的氦气 B.向A容器中再充人一定量的N2O4气体
C.适当降低A容器的温度 D.缩小B的体积
31.有a、b两个极易导热的密闭容器,a恒容,b恒压。在相同条件下将6mol A、2mol B混合于a容器中,将2mol C、1mol D混合于b容器中,发生反应:3A(g)+B(s)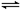 2C(g)+D(g)。(固体体积忽略不计)
2C(g)+D(g)。(固体体积忽略不计)
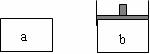
(1)达到平衡时,a中A的浓度为M mol/L、C的浓度为N mol/L;b中A的浓度为m mol/L,C的浓度为n mol/L。则M__ _2m; N___ __2n(填>、<、=、无法比较)
(2)保持温度不变,按下列配比分别充入a、b两容器,达平衡后a中C的浓度为N mol·L-1的是 ,b中C的浓度为n mo1·L-1的是 。
A.4mol C+2mol D B.3mol A+2molB C.1mol B+4mol C+2mol D
D.3mol A+1mol B E.1.5mol A+0.8mol B+1mol C+0.5mol D
(3)若将4mol C和4mol D充入a中,保持温度不变,平衡时A的浓度为W mol·L-1,C的浓度为Y mol·L-1,则W和M,Y和N之间的关系为
W__ _M,Y__ _N。(填>、<、=、无法比较)
30.2L密闭容器内,800℃:2NO(g)+O2(g) 2NO2(g),n(NO)随时间的变化如表:
2NO2(g),n(NO)随时间的变化如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
n(NO)(mol) |
0.020 |
0.01 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)若升温至850℃,平衡后n(NO)=n(NO2),则该反应是 热反应。
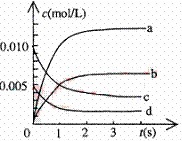 (2)右图中表示NO2的变化的曲线是
。
(2)右图中表示NO2的变化的曲线是
。
用O2表示从0~2s内该反应速率v= 。
(3)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=v正(O2) d.容器内密度保持不变
e.c(NO):c(O2):c(NO2)=2:1:2 f.NO和NO2浓度相等
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是 。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
(5)若在另外一个2L的容器中发生反应2NO+O2 2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,各物质的浓度可能是
。
2NO2,其中NO、O2、NO2的起始浓度依次是0.2 mol/L、0.1 mol/L、0.2 mol/L,当反应达到平衡时,各物质的浓度可能是
。
A.c(NO)=0.35 mol/L或c(NO)=0.09 mol/L B.c(NO2)=0.4 mol/L
C.c(NO2)=0.35 mol/L D.c(O2)=0.2 mol/L或c(NO)=0.4 mol/L
29.某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响;) |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
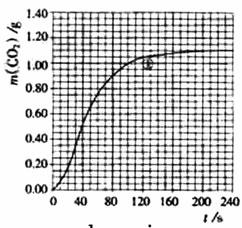
(2)实验①中CO2随时间变化关系见右图:依据反应方程式1/2CaCO3+HNO3=1/2Ca(NO3)2+1/2CO2↑+1/2H2O,计算实验①在70-90 s范围内HNO3的平均反应速率 。
(3)请图中画出实验②、③和④中CO2质量随时间变化关系的预期结果示意图。
28.在密闭容器中进行可逆反应: CO(g)+NO2(g)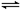 CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
CO2(g)+NO(g),(正反应放热),达到平衡后,只改变其中一个条件,对平衡的影响是:
①增大容器的体积,平衡 移动(填“正向”“逆向”“不”),反应混合物的颜色 。(填“变深”“变浅”“不变”)
②容器体积不变:若通人CO2气体,平衡 移动,反应混合物的颜色 。若通人N2气体,平衡 移动,反应混合物的颜色 。
③加入催化剂,平衡 移动。
27.在恒温恒容的密闭容器中,发生反应3A(g)+B(g)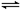 xC(g)。
xC(g)。
Ⅰ、将3molA和2molB在一定条件下反应,达平衡时C的体积分数为a;
Ⅱ、若起始时A、B、C投入的物质的量分别为n(A)、n(B)、n(C),平衡时C的体积分数也为a。下列说法正确的是
A.若Ⅰ达平衡时,A、B、C各增加1mol,则B的转化率将一定减小
B.若向Ⅰ平衡体系中再加入3molA和2molB,C的体积分数若大于a,可断定x>4
C.若x=2,则Ⅱ体系起始物质的量应当满足3n(B) =n(A)+3
D.若Ⅱ体系起始物质的量当满足3n(C) +8n(A)=12 n(B)时,可断定x=4
成都七中高2010级化学平衡测试题
班级 姓名 学号
第Ⅱ卷 非选择题
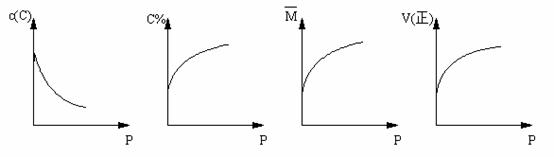
26.在一固定体积的密闭容器中,充入2molA和1molB,发生如下反应:2A(g)
+ B(g)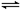 xC(g) ,平衡后,C的体积分数为W%。若维持容器容积和温度不变,0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
xC(g) ,平衡后,C的体积分数为W%。若维持容器容积和温度不变,0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数也为W% 。平衡后若缩小容器体积,C的浓度c(C)、C的体积分数C%、混合气体平均相对分子质量(M)和正反应速率[V(正)],随压强(P)的变化,一定符合的是
A B C D
25.在容积固定的1L密闭容器中,进行可逆反应X(g) +2Y(g)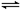 2M(g)+3N(g)并达到平衡,在此过程中,以Y的物质的量浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图所示。则图中阴影部分的面积在数值上不等于
2M(g)+3N(g)并达到平衡,在此过程中,以Y的物质的量浓度改变表示的反应速率v(正)、v(逆)与时间t的关系如图所示。则图中阴影部分的面积在数值上不等于
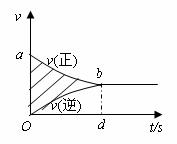
A.2倍X浓度的减小
B.1倍Y物质的量的减小
C.1倍M物质的量浓度的增加
D.3/2倍N物质的量浓度的增加
24.将一定量的Ag2SO4固体置于容积不变的容器中,在某温度下发生下列反应:
Ag2SO4(s)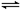 Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g)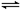 2SO2(g)+O2(g),经十分钟后,反应达到平衡,此时C(SO3)=0.4 mol/L,C(SO2)=0.1 mol/L,则下列叙述不正确的是
2SO2(g)+O2(g),经十分钟后,反应达到平衡,此时C(SO3)=0.4 mol/L,C(SO2)=0.1 mol/L,则下列叙述不正确的是
A.SO3的分解率为20% B.平衡时,v(O2)=0.005 mol/(L·min)
C.容器内气体的密度为40g/L D.加压,容器内固体质量不变
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com