
37.(1)一列沿 x 轴正方向传播的简谐横波在 t = 0时的波形如图所示,已知 t = 0.6 s时,B点第三次出现波峰.则这列波的周期是 ;x = 50 cm处的质点 A 回到平衡位置的最短时间为 .
 (2)半径为
R 的
(2)半径为
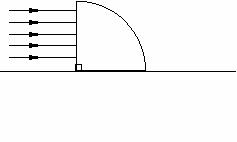
R 的 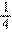 透明圆柱体固定于地面上,透明体对红光的折射率为 n = 2,如图所示.今让一束平行于地面的红光射向圆柱体左侧,经折射红光照射到右侧地面上.求圆柱体右侧地面上的黑暗部分长度.
透明圆柱体固定于地面上,透明体对红光的折射率为 n = 2,如图所示.今让一束平行于地面的红光射向圆柱体左侧,经折射红光照射到右侧地面上.求圆柱体右侧地面上的黑暗部分长度.
[物理 选修3-5]
36.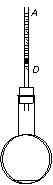 温度计是生活、生产中常用的仪器.图示为一个简易温度计装置,两端开口的细长玻璃管穿过橡皮塞插入烧瓶内,玻璃管内装有一小段有色液柱,封闭住一定质量的气体.当外界温度发生变化时,液柱将上下移动,经实验确定 A、D 间的刻度范围为 20℃-80℃,且
A、D 间刻度均匀.
温度计是生活、生产中常用的仪器.图示为一个简易温度计装置,两端开口的细长玻璃管穿过橡皮塞插入烧瓶内,玻璃管内装有一小段有色液柱,封闭住一定质量的气体.当外界温度发生变化时,液柱将上下移动,经实验确定 A、D 间的刻度范围为 20℃-80℃,且
A、D 间刻度均匀.
(1)液柱下端处于 D 点时,若封闭气体的密度为 ρ,摩尔质量为 M,那么气体分子间的平均距离的表达式为 .(阿伏伽德罗常数为 N,ρ、M 均为国际单位)
(2)液柱下端处于 A、D 间中点时,封闭气体的密度为 ρ 的多少倍?

[物理 选修3-4]
35.(8分)[生物-现代生物科技专题 ]
人的血清白蛋白(HAS)在临床上需求量很大,下图是利用奶牛乳汁生产人类血清白蛋白的图解,根据下图回答:
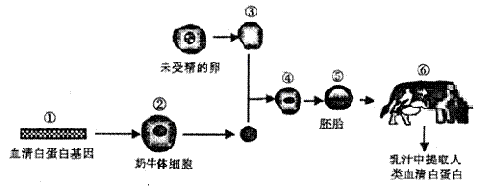
(1)在基因工程中,如果①的数量太少,常采用 技术扩增。在基因表达载体中,必须含有 ,便于检测目的基因是否导入受体细胞;目的基因的首端必须含有 ,它是RNA聚合酶的识别和结合位点,以使目的基因得以表达。
(2)实现①进入②的常用方法是 。
(3)在⑤的 时期植入母牛体内最佳。欲同时培育出多头完全相同的转基因牛犊,可以采用 技术。
(4)以上过程涉及到细胞水平的现代生物技术有 。
[物理 选修3-3]
34.(8分)[生物-生物技术实践 ]
苹果醋是指以苹果汁经发酵而成的苹果原醋,再兑以苹果汁等原料而成的饮品。既有淡淡的醋味,又有果汁的香甜,喝起来非常爽口。苹果醋还能保健养生、消除疲劳、美容养颜,是目前大众非常喜爱的饮品。下图是苹果醋的制作流程简图,请据图回答:
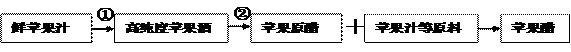
(1)为了提高该微生物的利用率,最好用 方法对其进行固定。若要检测是否产生了苹果酒可用 试剂进行检测。
(2)过程②中使用到的微生物是 ,该微生物的代谢类型是 。该微生物可以从食醋中分离纯化获得,方法是:
第一步:配置培养基。该培养基必须含有微生物生长所需要的 等基本营养成分。
第二步:对培养基用 方法进行灭菌。
第三步:接种。微生物常用的接种方法有 。
第四步:培养。温度控制在 。
第五步:挑选符合要求的菌落。
33.(8分)[化学-有机化学基础]
用芳香烃A为原料合成G的路线如下:
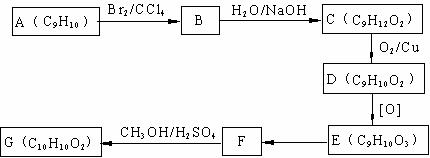
其中D分子苯环上只有一个支链,该分子在光照条件下与Cl2 发生取代反应生成的一氯代物只有一种,D与新制备的Cu(OH)2 悬浊液反应生成红色沉淀。
(1) 化合物 D的结构简式为 ,化合物E中的官能团有 (填名称);
(2)B→C的反应类型是 ,F→G的化学方程式为 ;
(3) 写出符合下列条件的F的同分异构体的结构简式 ;
ⅰ.分子内含苯环,且苯环上只有一个支链;
ⅱ.一定条件下,1 mol该物质与足量银氨溶液充分反应,生成4 mol银单质。
32.(8分)[化学-物质结构与性质]
A、B、C、D、E、F六种元素的原子序数依次递增。已知:
①F的原子序数为29,其余的均为短周期主族元素;②E原子价电子(外围电子)排布msnmpn-1 ;③D原子最外层电子数为偶数;④A、C原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)下列叙述正确的是 ;
A.金属键的强弱:D>E
B.基态原子第一电离能:D > E
C.五种元素中,电负性最大与最小的两种金属元素形成的晶体化学式为EB,属于离子晶体
D.晶格能:NaCl < DCl2
(2)F 的核外电子排布式是 ;与F同一周期的副族元素的基态原子中最外层电子数与F原子相同的元素有 (填元素符号)。
(3)A与C形成的非极性分子中,σ键与π键的键数之比为 ;该分子与过量强碱反应生成的酸根离子的空间构型为 ;
(4)已知原子数和价电子数相同的分子或离子为等电子体,互为等电子体的微粒结构相同。B3- 中心原子的杂化轨道类型为 。
31.(8分)[化学-化学与技术]
工业上制硫酸的设备分为三大部分,一是沸腾炉、二是接触室、三是吸收塔。在沸腾炉内煅烧黄铁矿生成二氧化硫;在接触室内有催化剂存在下二氧化硫 进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
进一步与氧气结合,生成三氧化硫;三氧化硫流经吸收塔时,采用98.3%的浓硫酸吸收,使三氧化硫最终与水化合形成硫酸。
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
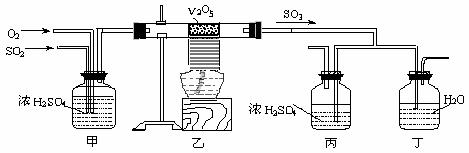
请回答下列问题:
(1) 写出沸腾炉内煅烧黄铁矿的反应方程式 ;
(2) 上图中的乙、丙分别相当于工业上制取硫酸装置中的 、 ;
(3) 丙中的现象为 、丁中的现象为 。
(4)下图是压强对SO2 平衡转化率的影响
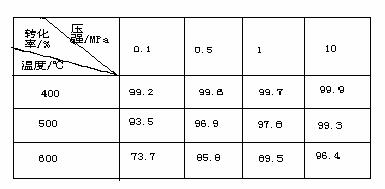
对SO2 转化为SO3的反应,增大压强可使转化率 ,之所以通常采用常压操作是因为 。
30.(14分)铁及其化合物在日常生活中应用广泛,请回答下列问题:
(1)Fe(NO3)3·9H2O易溶于水,微溶于硝酸,主要用作催化剂和媒染剂。工业上用细铁屑与稀硝酸反应制备,主要流程如下:
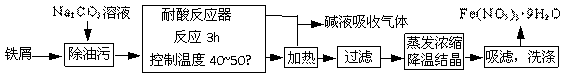
①Na2CO3 溶液可以除油污,原因是(用离子方程式表示)
 ;
;
 ②耐酸反应器中可以观察到的现象是 ;制备过程中需控制加入铁屑的量,当观察到
的现象时应停止加入铁屑;
②耐酸反应器中可以观察到的现象是 ;制备过程中需控制加入铁屑的量,当观察到
的现象时应停止加入铁屑;
③制得的Fe(NO3)3·9H2O用20% HNO3洗涤,其原因是  ;
;
④若在实验室中进行蒸发浓缩、降温结晶的操作,则所需的仪器有 ;
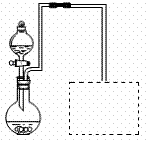
(2)某兴趣小组在实验室用右图装置制取Fe(NO3)3
(固定所用仪器和加热装置未画出)。
①该实验中对圆底烧瓶加热的最佳方式用 加热;
②装置中圆底烧瓶上方长导管的作用是 ;
③请在图中虚线框内画出防止倒吸的尾气吸收装置
(提示:碱液可快速、充分吸收产生的氮氧化物气体)。
[选做部分]
共8小题,考生从中选择2个物理、1个化学和1个生物题目作答。
29.(14分)现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体。
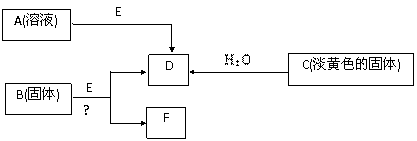
(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1 mol B转移5 mol 电子,则B与浓盐酸反应的化学方程式为 ,生成的氧化产物与还原产物的物质的量之比为 ;
(2)固体C与水反应生成D的化学方程式为 ;利用右上图所示的实验装置进行C与水的反应,检验导管出口气体的方法为 ;烧杯中的现象为 ;
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式 ;
若将浓度为 c1 的M溶液与0.2 mol·L-1 的一元酸HA等体积混合,所得溶液pH = 7,则
c1 (填“≥”、“=”或“≤”)0.2 mol·L-1 ,溶液中离子浓度的大小关系为 。
28.(14分)CO2 、SO2 、NOx 是对环境影响较 大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径。
大的气体,控制和治理CO2、SO2、NOx 是解决温室效应、减少酸雨和光化学烟雾的有效途径。
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx 浓度的有 (填字母)
a.减少化石燃料的使用,开发新能源
 b.使用无氟冰箱,减少氟里昂排放
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
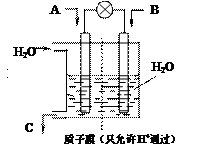
(2)有学者设想以右图所示装置用电化学原理将CO2、SO2 转化为重要化工原料。
若A为CO2,B为H2,C为CH3OH,则通入CO2
的一极为 极;若A为SO2,B为O2,C为H2SO4。则负极的电极反应式为 ;
(3)①在研究氮的氧化物的转化时,某小组查阅到以下数据:17℃、1.01×105 Pa时,
2NO2(g)  N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4 和NO2的混合气体达到平衡时,若 c (NO2) =
0.0300 mol·L-1, c (N2O4)= (保留两位有效数字);
N2O4(g) △H <0的平衡常数 K=13.3,则该条件下密闭容器中N2O4 和NO2的混合气体达到平衡时,若 c (NO2) =
0.0300 mol·L-1, c (N2O4)= (保留两位有效数字);
②若改变上述体系的某个条件,达到新的平衡后,测得混合气体中 c (NO2) = 0.04
 mol·L-1, c (N2O4) = 0.007 mol·L
mol·L-1, c (N2O4) = 0.007 mol·L -1,则改变的条件为
;
-1,则改变的条件为
;
(4)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。写出用合成气(CO和H2)生产甲醇的化学方程式
,已知该反应合成1 mol液态甲醇吸收热量131.9 kJ,2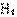 (g) + CO(g) +
(g) + CO(g) +
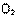 (g) =
(g) = 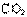 (g)
+2
(g)
+2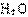 (g) △H =-594.1 kJ·mol-1,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式
。
(g) △H =-594.1 kJ·mol-1,请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com