
10.常温下,将pH = 5的硫酸溶液稀释到原来的500倍,则稀释后溶液中c(SO42-)与c(H+)之比大约为
A.1∶1 B.1∶10 C.1∶2 D.10∶1
9.在容积为2 L的密闭容器中,发生如下可逆反应:
m A(g) + n B(g) 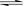 p C(g) + q
D(g)
p C(g) + q
D(g)
经过5 min达到平衡,此时A减少a mol/L,B的平均反应速率为a/15 mol/(L·min),C增加2a/3 mol/L,这时若增加系统压强,发现A与C的百分含量不变。则m∶n∶p∶q为
A.3∶1∶2∶2 B.1∶3∶2∶2 C.1∶1∶1∶1 D.1∶3∶2∶1
8.仅能在水溶液中导电的强电解质是
A.CH3COOH B.NaCl C.NH4HCO3 D.CO2
7.下列说法正确的是
A.室温下,pH = 9的碱性溶液中,可能存在CH3COOH分子
B.pH = 3的盐酸和pH = 5的硫酸等体积混合,pH = 4
C.中性溶液中必然有c(H+) = c(OH-) = 1×10-7 mol/L
D.在0.1 mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小
6.能确认化学平衡状态发生了移动的是
A.化学反应速率发生了改变
B.有气态物质参加的可逆反应达到平衡后,改变了压强
C.由于某一条件的改变,使平衡混合物中各组分的浓度发生了不同程度的改变
D.可逆反应达到平衡后,使用催化剂
5.下列操作能使H2O的电离平衡向逆方向移动,且溶液呈碱性的是
A.向水中加NaHCO3 B.向水中加NaHSO4
C.向水中加FeCl3 D.向水中加CaO
4.在10℃时某化学反应速率为0.1 mol/(L·s),若温度每升高10℃,反应速率增加到原来的3倍。为了把该反应速率提高到8.1 mol/(L·s),则该反应需在什么温度下进行
A.30℃ B.40℃ C.50℃ D.60℃
3.下表中物质的分类组合,完全正确的是
|
编号 |
A |
B |
C |
D |
|
强电解质 |
KNO3 |
H2SO4 |
BaSO4 |
HClO4 |
|
弱电解质 |
NH3·H2O |
CaCO3 |
HClO |
C2H5OH |
|
非电解质 |
SO2 |
Al |
H2O |
CH3COOH |
2.下列各种试纸,在使用时预先不能用蒸馏水润湿的是
A.碘化钾淀粉试纸 B.pH试纸
C.品红试纸 D.蓝色石蕊试纸
1.下列有关化学反应速率的说法中,正确的是
A.100 mL 1 mol/L的稀硫酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
B.合成氨的反应是一个放热反应,所以升高温度,反应速率减慢
C.用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率
D.汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com