
30.(10分)(1)在25℃时,已知0.1 mol/L HCN溶液的pH = 4,0.1 mol/L NaCN溶液的pH = 12。现将0.2 mol/L的HCN溶液和0.1 mol/L的NaOH溶液等体积混合后,混合溶液呈______性(填“酸”、“碱”或“中”),混合溶液中各种离子的浓度关系为:
________________________________________________________________________。
(2)常温下,将0.01 mol CH3COONa和0.006 mol HCl溶于水,配制成0.5 L混合溶液。试回答下列问题:
①溶液中共有_________种粒子。
②溶液中有两种粒子的物质的量浓度之和一定等于0.02 mol/L,它们是_________________和____________________。
③溶液中n(OH-) + n(CH3COO-) - n(H+) = ____________mol。
29.(15分)Ⅰ.醋酸是一种常见的弱酸,为了证明醋酸是弱电解质,某校研究性学习小组开展了题为“醋酸是弱电解质的实验研究”的探究活动。该校研究性学习小组设计了如下方案:
A.先配制一定量的0.10 mol/L CH3COOH溶液,然后测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先测0.10 mol/L CH3COOH溶液的pH,然后将其加热至40℃,再测pH,如果pH变小,则可证明醋酸为弱电解质
C.先配制一定量0.01 mol/L和0.10 mol/L的CH3COOH溶液,分别测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸为弱电解质
D.在常温下,配制一定量的CH3COONa溶液,测其pH,若pH大于7,则可证明醋酸为弱电解质
你认为上述方案可行的是________________________________。
Ⅱ.次氯酸和高碘酸(H5IO6)都是实验室中常用的氧化剂,都可在实验室用简易方法制得。
(1)将大理石颗粒投入到饱和氯水中,待溶液的黄绿色褪去,就得到了较浓的次氯酸溶液。今有100 mL饱和氯水,投入过量大理石,记录到:没有CO2逸出,溶液中有大量的HCO3-。反应后取出大理石称重,其质量减少了m g。若溶液体积变化忽略不计,则该溶液中次氯酸的物质的量浓度为____________mol/L。
(2)25℃,已知pH = 2的高碘酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显酸性;0.01 mol/L的碘酸或高锰酸溶液与pH = 12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是____________(填“强酸”或“弱酸”);高锰酸是___________(填“强酸”或“弱酸”)。将可溶性的高碘酸钡[Ba5(IO6)2]与稀硫酸混合,发生反应的离子方程式为:
_____________________________________________________________________________。(3)将高浓度的HClO溶液加入到碘酸(HIO3)溶液中,同样可制得高碘酸,同时有盐酸
生成,该反应的化学方程式为__________________________________________________。
有同学认为:“此反应由弱酸HClO生成了强酸盐酸,不符合化学反应规律”,请根据你对化
学反应规律的理解,对该同学的观点加以评价并说明理由____________________________
______________________________________________________________________________
_____________________________________________________________________。
28.(15分)(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
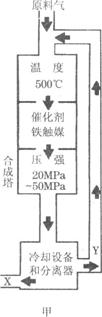
①X的化学式为__________,属于________(填“极性”或“非极性”)分子。
②图甲中条件选定的主要原因是(选填字母序号,下同)____________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
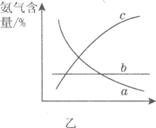
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百
分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
________________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大到小依次为:______________________________________________________________。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式:_______________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为__________mol。
27.(14分)一定温度下,将3 mol A气体和1
mol B气体通入一密闭容器中,发生如下反应:3A(g) + B(g) 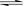 xC(g)
xC(g)
请填写下列空白:
(1)若容器体积固定为2 L,反应2 min时测得剩余0.6 mol B,C的浓度为0.4 mol/L。
①2 min内,A的平均反应速率为__________________;x = ____________。
②若反应经4 min达到平衡,平衡时C的浓度________ 0.8 mol/L(填“大于”、“等于”或“小于”)。
③平衡混合物中,C的体积分数为22%,则B的转化率是______________。
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应该满足的关系式为:
____________________________________________________________________。
(2)若维持容器压强不变
①达到平衡时C的体积分数____________22%(填“大于”、“等于”或“小于”)。
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________ mol A气体和 mol B气体。
26.(6分)普通泡沫灭火器的玻璃筒内盛有Al2(SO4)3溶液,铁筒内盛有NaHCO3溶液。
(1)其灭火的原理为(用离子方程式表示)_______________________________________。
(2)使用时,相同浓度的Al2(SO4)3溶液和NaHCO3溶液的体积比约为_____________。
(3)不能把Al2(SO4)3溶液盛在铁筒内的原因是_________________________________
________________________________________________________________________。
25.在通常温度下,将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是
A.若混合前pH酸+pH碱=14,则HA肯定是弱酸
B.若混合前酸、碱的物质的量浓度相同,则HA肯定是弱酸
C.溶液中水的电离程度一定是:纯水> 混合溶液> HA溶液
D.混合溶液中离子浓度一定满足:c(B+) > c(A-) > c(H+) > c(OH-)
成 都 七 中 2008 - 2009 学 年 上 期
高2010年级期中考试化学试卷
第Ⅱ卷(非选择题 共60分)
24.已知CH3COOH的酸性比HClO的酸性强。现有物质的量浓度和体积均相同的CH3COONa和NaClO两种溶液,已知前者溶液中离子数目为N1,后者溶液中离子数目为N2。下列关系中正确的是
①N1 = N2 ②N1 > N2 ③N1 < N2 ④c(CH3COO-) < c(ClO-)
A.① B.② C.③ D.④
23.某温度下,在密闭容器中发生如下反应:2M(g) + N(g) 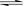 2E(g)
2E(g)
若开始时只充入2 mol E气体,达平衡时,混合气体的压强比起始增大了20%;若开始时只充入3 mol M和1 mol N的混合气体,达到平衡时N的转化率为
A.< 60% B.= 40% C.< 40% D.> 60%
22.广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合成新的物质。根据上述观点,下列说法不正确的是
A.CaO2的水解产物是Ca(OH)2和H2O2
B.NaClO的水解产物是HClO和NaOH
C.CuCl2的水解产物是Cu(OH)2和HCl
D.PCl3的水解产物是PH3和HClO
21.已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1 mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各种粒子的物质的量浓度的关系中(R表示S或C),一定正确的是
A.c(Na+) > c(HRO3-) > c(H+) > c(RO32-) > c(OH-)
B.c(HRO3-) + c(RO32-) + c(OH-) = c(H+) + c(Na+)
C.c(H+) + c(H2RO3) = c(OH-) + c(RO32-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com