
1. 设全集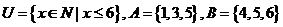 ,则
,则 等于
等于
A、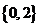 B、
B、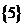 C、
C、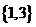 D、
D、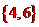
24.(14分)为测定碳酸钙纯度(设含杂质SiO2),某学生设计了如下几个实验方案,请回答每个方案中的问题:
方案I:①称取碳酸钙样品mg ②高温煅烧1000℃直至质量不再改变,冷却后称量质量为m′g
(1)确定质量已不再改变的方法是 。
方案II:① 称取碳酸钙样品mg ②用c mol/L盐酸V mL(过量)溶解样品 ③取溶解后溶液的1/10 ④用c′mol/L的NaOH溶液滴定恰好用去V′mL
(2)列出本实验④中还需用的试剂、仪器名称(除铁架台、烧杯、铁夹及附件外):
(3)加盐酸后,是否需要滤出SiO2后再用NaOH滴定 (选填“需要”或“不需要”)。
(4)碳酸钙纯度计算列式 。
方案III:①称量碳酸钙样品m g ②加入足量c mol/L HCl VmL,使之完全溶解 ③过滤并取滤液 ④在滤液中加入过量c′mol/L Na2CO3溶液V′mL ⑤将步骤④中沉淀滤出,洗涤干燥,称量m′g
(5)此方案中不需要的数据是 (填序号)。
A.c V B.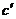
 C.
C.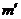 D.m
D.m
(6)为减少误差,步骤④还应 (填序号)。
A.精确测定Na2CO3溶液体积 mol
B.精确配制Na2CO3溶液浓度
mol
B.精确配制Na2CO3溶液浓度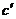 mol/L
mol/L
C.将步骤③所得沉淀洗涤,洗涤液应一起并入④中
你认为上述三个设计方案中,最佳的是方案 (选填“I”、“II”、“III”)。
23、(9分)燃料电池是使气体燃料氧化直接产生电流的装置。一种新型燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的Zr2O2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
(1)该电池放电时的化学反应方程式为 。
(2)该燃料电池的电极反应式为:
电池正极 13O2+52e- 26O2-
电池负极 。
固体电解质中的O2-向 极移动(填“正”或“负”)
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3360mL(标准状况)氧气,阴极析出金属10.4g,在该含氧酸盐中金属的化合价为 ,在该实验中,若不考虑能量的损失,电池中消耗丁烷的质量最少是 g(结果精确至0.01g)。
22.(9 分)(1)0.02 mol·L-1的HCN溶液与0.02 mol·L-1 NaCN溶液等体积混合,已知该混合溶液中c(Na+)> c(CN-),用“>、<、=”符号填空
①溶液中c(OH -) c(H +) ② c(HCN) c(CN-)
(2)常温下,向Al2(SO4)3溶液中滴入Ba(OH)2溶液至Al3+ 刚好完全沉淀时,溶液pH ________7,(用“>”“<”“=”符号填空)。
反应的离子方程式为______________________________________________________。
(3)0.01 mol CH3COONa和0.005 mol HCl溶于水,配制成1 L溶液,溶液中微粒共有________种,溶液中两种微粒的物质的量浓度之和一定等于0.01 mol·L-1的是_________和__________。
20、(7分)(1)某温度(t ℃)时,水得到KW=10-13,则该温度______25℃,(填“<”“>”或“=”),将此温度下pH=11的氢氧化钠溶液a L与pH=1的硫酸溶液b L混合。
①若所得混合液为中性,则a:b= 。
②若所得混合液的pH=2,则a:b= 。
(2)在25℃时,若100体积的某强酸溶液与1体积的某强碱溶液混合溶液中性,混合前强酸的pH和强碱的pH应该的关系是________________________。
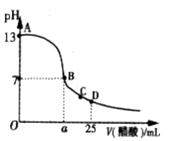 21、(10 分)在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。
21、(10 分)在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式
______________________________________。
(2)该氢氧化钠溶液浓度为________________。
(3)在B点,a_________12.5 mL(填“<”“>”或“=”)。
若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好
呈中性,则混合前c(NaOH) c(CH3COOH),混合
前酸中c(H +)和碱中的c(OH -)的关系:c(H +) c(OH -)(填“<”“>”或“=”)。
(4)在D点,溶液中离子浓度大小关系为______________________________________。
19、(7分)对0.5 mol·L-1的氨水,分别加入下列各物质或进行某项操作:
A、4 mol·L-1氨水、B、纯水、C、少量NH4Cl晶体、D、少量浓醋酸、E、少量Na2CO3粉末、F、少量FeCl3晶体、G、加热、用序号填写下列空白:
(1)能使pH减小,c(NH4+)增大的是__________________,
(2)能使pH增大,c(NH4+)减少的是__________________,
(3)能使pH增大,c(NH4+)也增大的是__________________,
(4)能使pH减小,c(NH4+)也减小的是__________________。
18、草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/L NaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是 ( )
A.V(NaOH)== 0时,c(H+)== 1 × 10-2 mol/L
B.V(NaOH)< 10 mL时,不可能存在c(Na+)== 2 c(C2O42- )+ c(HC2O4-)
C.V(NaOH)== 10 mL时,c(H+)== 1 × 10-7 mol/L
D.V(NaOH)> 10 mL时,c(Na+)> c(C2O42-)>c(HC2O4-)
班级 学号 姓名
17、如图,A池用石墨电极电解NaOH溶液,B池精炼粗铜,一段时间后停止通电,A池中D极产生具有氧化性的气体在标准状况下为2.24 L。下列说法正确的是 ( )
A.B池为原电池,电源左端为正极
B.D、E两极都发生氧化反应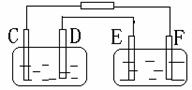
C.F极是以粗铜板为材料作阴极
D.B池中E极质量增加12.8g
16、将一元酸HA的溶液与一元碱BOH的溶液等体积混合,若所得溶液呈酸性,下列有关判断正确的是 ( )
A.若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸
B.溶液中水的电离程度:混合溶液>纯水>BOH溶液
C.若混合前酸、碱pH之和等于14,则HA肯定是弱酸
D.混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
15、人们研究出一种高能电池--钠硫电池,它是以熔融的钠、硫为两极,以Na+导电的
 β1-Al2O3陶瓷作固体电解质,反应如下:2Na+xS Na2Sx
β1-Al2O3陶瓷作固体电解质,反应如下:2Na+xS Na2Sx
以下说法,正确的是 ( )
A.放电时,钠极发生还原反应
B.放电时,钠作正极,硫作负极
C.充电时,阳极发生的反应是:Sx2- -2e- = xS
D.充电时,钠极与外电源的正极相连,硫极与外电源的负极相连
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com