
6.(2009·宜昌模拟)鉴别Cl-、Br-、I-三种离子,不宜选用的试剂组是 ( )
A.AgNO3溶液和稀硝酸 B.溴水和淀粉溶液
C.氯水和CCl4溶液 D.氯水和淀粉溶液
答案:B
5.下列说法不正确的是 ( )
A.碘易升华,应该密封保存
B.液溴应保存在磨口玻璃塞深棕色细口试剂瓶中,并加少量水进行水封
C.酒精与水互溶,所以不能用酒精把碘从碘水中萃取出来
D.用加热的方法可以将NH4Cl与碘的混合物分离
答案:D
4.下列离子方程式正确的是 ( )
①氯气与水反应:Cl2+H2O===2H++Cl-+ClO-
②氯气与氢氧化钠溶液反应:
Cl2+2OH-===Cl-+ClO-+H2O
③浓盐酸与二氧化锰共热:
MnO2+4HClMn2++2Cl-+Cl2↑+2H2O
④漂白粉溶液中通入少量的二氧化碳气体:
Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO
A.①③ B.②④
C.②③ D.①④
答案:B
3.(2009·泉州模拟)下列物质与其用途相符合的是 ( )
①Cl2-做消毒剂 ②AgBr-制胶卷、感光纸
③AgI-人工降雨 ④碘-预防甲状腺肿大
⑤淀粉-检验I2的存在 ⑥NaClO-漂白纺织物
A.②③④⑤⑥ B.①②③④⑤
C.②③④⑤ D.全部
答案:D
2.自来水厂常使用氯气消毒,市场上有些小商贩用自来水充当纯净水出售。下列试剂中可用来辨别纯净水真伪的是 ( )
A.酚酞试液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
答案:D
1.(2009·芜湖模拟)下列说法正确的是 ( )
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2可将气体通入饱和食盐水
A.①②③ B.②③④
C.③ D.③⑤
答案:C
22.(2007·广东汕尾调研)X、Y、Z为短周期元素的单质,X、Y的组成元素为同主族元素,U、V为它们的化合物,这些物质之间的转化关系如右图所示,其中反应条件和某些产物已经略去。

(1)若V是水,则:①X是________、U是________
②由于U有剧毒,工业上产生的U要经过处理变成单质Y后方能排放,以防止大气污染。富玛克斯法治理U的方法和步骤如下:
第一步:用2%-3%的Na2CO3溶液作为吸收剂生成2种酸式盐;
第二步:再加入一种RNO(溶液)(R表示芳香烃基)与生成的一种酸式盐的水溶液反应生成硫、碱和RNHOH;
第三步:第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
第四步:RNHOH与空气中的氧发生反应又得到RNO。
则:第一步反应的化学方程式为___________________。
总反应的化学方程式为: ____________________。
请对富玛克斯法的优点做一简要评价: ________________。
(2)若U、V均为氧化物,则:①写出反应Ⅰ的化学方程式: _____________________。
②计算机长距离联网使用的传输速度快、信息量大的线路,使用的材料的主要化学成分是U,该材料的名称是:______________________。
③这种材料埋在地下时,如果裸露在碱性土壤中,结果会断路,用离子方程式说明原因________________________________________________________________________
________________________________________________________________________。
解析:因为X、Y是同主族元素,且由题意可推知X+U―→V+Y是一个置换反应。(1)V是水,U有剧毒,可推出U是H2S,X是O2,Y是S。(2)若U、V均为氧化物,则符合它的置换反应是C与SiO2的反应,故X是C,U是SiO2,Y是Si,V是CO。
答案:(1)①O2 H2S
②Na2CO3+H2S===NaHCO3+NaHS 总反应为:2H2S+O22H2O+2S↓;RNO反应前后不变,起到催化剂的作用,是一条绿色工艺流程。
(2)①SiO2+2CSi+2CO↑ ②光导纤维 ③SiO2+2OH-===SiO+H2O
21.(2008·烟台期中)往100 mL的NaOH溶液中通入CO2充分反应后,在减压和较低温度下,小心地将溶液蒸干,得到白色固体M。通入的CO2的体积V(标准状况)与M的质量W的关系如下图所示。试解答下列问题:

(1)A点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL(标准状况下,下同)。
(2)C点时,白色固体M的化学式为____________________,通入的CO2的体积为________ mL。
(3)B点时M的组成成分为________(用化学式表示),通入的CO2的体积为________ mL。
(4)该NaOH溶液的物质的量浓度为________。
解析:CO2通入NaOH溶液中,首先生成Na2CO3和水,继续通入CO2,Na2CO3与CO2和水继续反应生成NaHCO3。这两种情况下,所得产物的质量比为53?84。由此不难判断A点时M的化学式为Na2CO3;据此可以计算通入CO2的量;同理可以判断C点时M为NaHCO3,据此也可计算CO2的用量。从图可知NaOH的质量为4 g,n(NaOH)=0.1 mol。完全转化为Na2CO3时,m(Na2CO3)=5.3 g,完全转化为NaHCO3时,m(NaHCO3)=8.4 g,因B点时M质量为7.16 g,5.3>7.16>8.4,知M为Na2CO3和NaHCO3的混合物。设B点时Na2CO3的物质的量为x mol,NaHCO3的物质的量为y mol,则有:2x+y=0.1,106x+84y=7.16,解得:x=0.02 mol,y=0.06 mol,所以V(CO2)=(0.02+0.06) mol×22.4 L/mol×1000 mL/L=1792 mL。可进一步计算出NaOH溶液的浓度为1.0 mol·L-1。
答案:(1)Na2CO3 1120 (2)NaHCO3 2240 (3)Na2CO3和NaHCO3 1792 (4)1.0 mol·L-1
20.按要求完成下列各题的填空。
(1)若CO2中混有CO,除去的方法是__________________________;
(2)若CO2中混有HCl,要得到纯净的CO2,其方法是_______________________;
(3)将镁条在空气中点燃后伸入装有纯净CO2的集气瓶中,观察到的现象是(不必写产物的名称或分子式)_______ ______________________;
(4)在没有现成的CO2气体发生器的情况下,请选用下图中的部分仪器,装配一个简易的、能随用随开、随关随停的CO2气体发生装置,应选用的仪器是(填入编号)________;
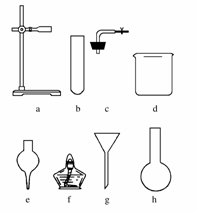
(5)若用上述装置产生CO2气体,而实验室只有稀硫酸、浓硝酸、水、块状大理石,比较合理的方案应选用的药品是________________________
解析:(1)利用CO有还原性,CO2没还原性这一性质差异,将含CO杂质的气体通过灼热的CuO除去CO。
(2)因为CO2是酸性氧化物,因而在除去CO2中的HCl时,既要考虑选择碱性试剂,又要尽量减少CO2在其中的溶解度,同时要注意题目要求得到“纯净的CO2”,所以这里除要用饱和NaHCO3溶液(或水)洗涤外,还要用浓硫酸来干燥(除去水分)。
(3)镁条点燃在纯净的CO2中燃烧,是课堂演示实验,如果学生在实验时仔细观察,回答此问并不困难。
(4)本题实质是考查学生是否掌握启普发生器的原理,用干燥管、烧杯和单孔塞组合,可以取代启普发生器中的“球形漏斗”和“容器”这两个核心部分,从而达到随关随停的目的。
(5)选用试剂时要注意,题目没有提供学生熟悉的盐酸,而硫酸会与大理石生成CaSO4沉淀,包在其表面,阻止CaCO3继续和酸作用产生CO2;块状Na2CO3遇酸会溶解,使制气装置起不到随关随停的作用,本题只能选用大理石、浓硝酸和水。
答案:(1)通过灼热的CuO (2)先用饱和的NaHCO3溶液洗涤(或用水洗),再用浓硫酸干燥 (3)镁条继续燃烧,瓶壁有白色和黑色固体 (4)a、c、d、e (5)浓硝酸、水、块状大理石
19.(2009·重庆)化合物A由周期不同的短周期元素X、Y组成,是良好的耐热冲击材料。
(1)X的单质既可与盐酸反应,又可与NaOH溶液反应,X的原子结构示意图为________。
(2)X的硫酸盐溶液与过量NaOH溶液反应的离子方程式为_______________________。
(3)一定条件下,A和水缓慢作用生成含Y的化合物Z,Z分子含有10个电子。
①Z与H2O2反应,其产物之一是Y的单质,Y的单质的电子式为________;Z分子的结构呈________。
②A的化学式是_______________________。
(4)X的单质、石墨和二氧化钛(TiO2)按比例混合,高温下反应得到的化合物均由两种元素组成,且都是新型陶瓷材料(在火箭和导弹上有重要应用),其反应的化学方程式是________________________________________________________________________
________________________________________________________________________。
解析:由(1)知,X为Al,由(3)并结合题干“耐热冲击材料”确定Y为N,A为AlN。
答案:(1)  (2)Al3++4OH-===AlO+2H2O
(2)Al3++4OH-===AlO+2H2O
(3)①?N⋮⋮N? 三角锥形 ②AlN
(4)4Al+3TiO2+3C2Al2O3+3TiC
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com