
5.如图所示,在一盛有蒸馏水的烧杯中有一悬浮的小球,当向烧杯中加入(或通入)下列物质后,小球沉到水底的是 ( )
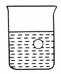
A.HCl B.NH3
C.浓H2SO4 D.浓HNO3
答案:B
4.(2008·江苏省竞赛)下列关系图中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。当X无论是强酸还是强碱时都有如下转化关系(其他反应产物及反应所需条件均已略去),当X是强碱时,过量的B跟Cl2反应除生成C外,另一产物是盐酸盐。
下列说法中不正确的是 ( )
A.当X是强酸时,A、B、C、D、E、F中均含同一种元素,F可能是H2SO4
B.当X是强碱时,A、B、C、D、E、F中均含同一种元素,F是HNO3
C.B和Cl2的反应是氧化还原反应
D.当X是强酸时,C在常温下是气态单质
解析:当X是强酸如盐酸时,若A是硫化钠,则B是硫化氢,C是硫,D是二氧化硫,E是三氧化硫,F是H2SO4;当X是强碱时,若A是铵盐,B是氨气,C是氮气,D是一氧化氮,E是二氧化氮,F是HNO3;B和Cl2的反应可能是:H2S+Cl2===S+2HCl或8NH3+3Cl2===N2+6NH4Cl。当X是强酸时,C在常温下只能是固态单质S。答案为D。
答案:D
3.有关气体制备所用试剂及检验气体所用试剂完全正确的组合是( )
A.CO2:大理石和稀硫酸 澄清石灰水
B.Cl2:二氧化锰和浓盐酸 品红溶液
C.O2:二氧化锰和双氧水 带火星的木条
D.NH3:氯化铵和氢氧化钠固体 浓盐酸
解析:A项,大理石与稀H2SO4反应生成微溶性的CaSO4,会使反应逐渐停止;B项,检验Cl2一般用湿润的淀粉-KI试纸或紫色石蕊试液,而不用品红溶液;D项,制取NH3应用NH4Cl固体和Ca(OH)2固体,不能用NaOH固体,因为NaOH会与玻璃试管的主要成分SiO2发生反应。
答案:C
2.下列有关氨的性质的叙述中正确的是 ( )
①氨不能在空气中燃烧 ②氨水呈碱性 ③氨气和酸相遇都能产生白色烟 ④在反应:NH3+H+===NH中氨失去电子被氧化 ⑤氨水中含氮微粒中最多的是NH ⑥常温下把NH3通入稀HNO3中,当溶液的pH等于7时,NH3和HNO3等物质的量反应
A.①② B.③⑤⑥
C.①⑤⑥ D.②⑤⑥
解析:氨在空气中氧化需高温和催化剂;由于氨水中存在平衡:NH3+H2ONH3·H2ONH+OH-,故氨水呈弱碱性;氨气只有与挥发性酸相遇才能产生白色烟,与不挥发性酸如H2SO4、H3PO4相遇,不产生白色烟;NH3和H+的反应为非氧化还原反应。故①、②正确,③、④不正确。在氨水中,NH3·H2O是一元弱碱,电离很微弱,含氮微粒最多的是NH3·H2O,⑤错。当NH3和HNO3等物质的量反应时生成NH4NO3,因NH水解而使溶液呈酸性,⑥错。
答案:A
1.不需要在棕色瓶中存放的物质是 ( )

答案:D
7.5 g-0.1 mol×65 g·mol-1=1.0 g。
Zn + CuSO4===ZnSO4 + Cu Δm(固)
65 g 1 mol 64 g 1.0 g
Cu + 2H2SO4(浓)CuSO4+SO2↑+2H2O
2 mol 1 mol
c(H2SO4)==17.5 mol·L-1
0.1 mol 0.1 mol 0.1 mol
Zn与CuSO4反应固体减轻:
21.向铜片中加某浓度的硫酸120 mL,在加热条件下反应,待铜片全部溶解后,将其溶液稀释到500 mL,再加入足量锌粉,使之充分反应收集到标准状况下气体2.24 L,过滤残留固体,干燥后称量,质量减轻了7.5 g,求原硫酸的物质的量浓度。
解析:Zn + H2SO4(稀)===ZnSO4+H2↑
20.(2009·全国卷Ⅰ)浓H2SO4和木炭在加热时发生反应的化学方程式是
2H2SO4(浓)+CCO2↑+2H2O+2SO2↑
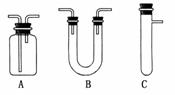
请从上图中选用所需的仪器(可重复选用)组成一套进行该反应并检出反应产物的装置。现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)
将所选的仪器按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称及其作用。
|
选用的仪器(填字母) |
加入的试剂 |
作用 |
|
|
|
|
|
|
解析:本题为气体的制取与性质检验。选择的装置连接顺序为C→B→A→A→A(或C→B→A→A→A→A),加入的试剂依次为木炭和浓H2SO4、无水CuSO4、品红溶液、酸性KMnO4溶液、澄清石灰水(也可在酸性KMnO4溶液后加品红溶液),作用分别是制取气体,检验H2O(g)、检验SO2、除去SO2、检验CO2。
答案:
|
选用的仪器 (填字母) |
加入的试剂 |
作用 |
|
C |
浓H2SO4和木炭 |
反应器(或发生气体) |
|
B |
无水CuSO4 |
检出H2O |
|
A |
品红溶液 |
检出SO2 |
|
A |
酸性KMnO4溶液 |
吸收余下的SO2 |
|
A |
澄清石灰水 |
检出CO2 |
19.某亚硫酸钠试剂,已部分被氧化。为确定其纯度,要进行如下实验:①称取样品W1 g;②将样品溶解;③向溶液中加入稍过量盐酸酸化的BaCl2溶液;④过滤、洗涤、干燥沉淀,称其质量为W2 g,回答:
(1)BaCl2要用盐酸酸化的原因是____________________________。
(2)BaCl2溶液要稍过量的原因是____________________________。
(3)判断操作③完成的方法是____________________________。
(4)判断沉淀洗净的方法是____________________________。
(5)Na2SO3纯度的表达式:____________________________。
答案:(1)完全除去Na2SO3,避免生成BaSO3沉淀 (2)使SO完全沉淀 (3)在上层清液中继续加入盐酸酸化的BaCl2溶液,无沉淀产生 (4)在最后一次洗涤液中加入AgNO3溶液,无白色沉淀产生 (5)1-×100%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com