
21.(6分)氯酸是一种强酸,氯酸的浓度超过 40% ,就会迅速分解,产生比它的酸性更强的酸,同时放出气体,该气体混合物(气体为单质气体的混合物)经干燥后,平均分子量为 47.6,它可以使带火星的木条复燃,并可使润湿的淀粉-碘化钾试纸变蓝后又褪色。试完成下列各题:
(1)该气体的组成是 ,气体混合物的物质的量比为 。
(2)写出氯酸分解方程式并配平: ,
该反应的还原产物是 (写化学式)。
(3)结合化学反应方程式解释,该气体使润湿的淀粉-碘化钾试纸变蓝后又褪色的原因: 。
20. 质量分数为 a 的某物质的溶液 m g与质量分数为 b 的该物质的溶液 ng混合后,蒸发掉 pg水。得到的溶液每毫升质量为 qg,物质的量浓度为 c。则溶质的相对分子质量为
A .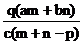 B.
B.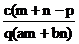 C.
C. D.
D.
第Ⅱ卷(共40分)
班级___________ 学号____________ 姓名____________
19. 有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是
A.氧化剂与还原剂的物质的量之比为8︰l B.还原产物为NH4+
C.若有l mol NO3-参加还原反应,则转移8mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
18.有下列五个化学方程式(X、Y、Z均为正值):

 ①C2H2(g)+H2(g) C2H4(g)
①C2H2(g)+H2(g) C2H4(g)
|
 C2H4(g)
C2H4(g)
 ③C(s)+2H2(g) CH4(g);△H=-X kJ·mol-1
③C(s)+2H2(g) CH4(g);△H=-X kJ·mol-1
 ④C(s)+
④C(s)+ H2(g)
H2(g)  C2H2(g);△H=-Y kJ·mol-1
C2H2(g);△H=-Y kJ·mol-1
 ⑤C(s)+H2(g)
⑤C(s)+H2(g)  C2H4(g);△H=-Z kJ·mol-1
C2H4(g);△H=-Z kJ·mol-1
当温度下降时①式平衡向右移动,②式平衡向左移动。据此判定③-⑤式中关于X、Y、Z的大小顺序排列正确的是
A.X>y>Z B.X>Z>Y C.Y>X>Z D.Z>X>Y
17.甲、乙两同学从同一溶液中各取出100g做如下实验:甲将溶液蒸发掉20g水后冷却到室温,析出3.6g晶体(不含结晶水);乙将溶液蒸发掉30g水后冷却到室温,析出6.0g晶体,若两同学实验都正确无误,则200g该溶液蒸发掉20g水后冷却到室温,析出晶体的质量为
A.0 g B.2.4 g C.4.8 g D.9.6 g
16.向含有1molHCl和1mol MgSO4的混合溶液中加入1mol·L‾1 的Ba(OH)2溶液,产生沉淀的物质的量(n)与加入Ba(OH)2溶液的体积(V)之间的关系图正确的是
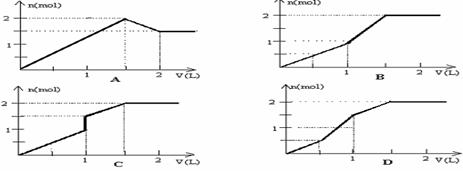
15.把Fe和Fe2O3组成的某混合物放入250mL2.0mol·L-1的HNO3溶液中,充分反应后,生成的NO气体在标准状况下的体积为1.12L,再向反应后的溶液中加入1.0mol·L-1的NaOH溶液,要使铁元素完全沉淀下来,所加入的NaOH溶液的体积最少是( )
A.400mL B.450mL C.500mL D.550mL
0.1mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH (不考虑二氧化碳的溶解)。则
电解过程中转移的电子的物质的量为
A.0.4mol B.0.5mol C.0.6mol D.0.8mol
14.用惰性电极电解一定浓度的CuSO4溶液时,通电一段时间后,向所得的溶液中加入
13.某溶液能完全溶解乙酸乙酯,在该溶液中可以大量共存的离子组是
A.K+、Na+、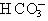 、Cl-
B.Ag+、
、Cl-
B.Ag+、 、
、 、Br-
、Br-
C.Mg2+、H+、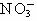 、
、 D.K+、Na+、
D.K+、Na+、 、
、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com