
30.(05天津)下列说法中正确的是
A.一定质量气体被压缩时,气体压强不一定增大
B.一定质量气体温度不变压强增大时,其体积也增大
C.气体压强是由气体分子间的斥力产生的
D.在失重情况下,密闭容器内的气体对器壁没有压强
29.(04春季高考)一定质量的理想气体处于某一平衡状态,此时其压强为P0,有人设计了四种途径,使气体经过每种途经后压强仍为P0.这四种途径是:
①先保持体积不变,降低压强,再保持温度不变,压缩体积
②先保持体积不变,使气体升温,再保持温度不变,让体积膨胀
③先保持温度不变,使体积膨胀,再保持体积不变,使气体升温
④先保持温度不变,压缩气体,再保持体积不变,使气体降温可以断定
A.①②不可能 B.③④不可能 C.①③不可能 D.①②③④都可能
28.(06四川)对一定质量的气体,下列说法中正确的是
A.温度升高,压强一定增大
B.温度升高,分子热运动的平均动能一定增大
C.压强增大,体积一定减小
D.吸收热量,可能使分子热运动加剧、气体体积增大
27.(05全国)对于定量气体,可能发生的过程是
A.等压压缩,温度降低 B.等温吸热,体积不变
C.放出热量,内能增加 D.绝热压缩,内能不变
26.(03江苏)一定质量的理想气体
A.先等压膨胀,再等容降温,其温度必低于起始温度
B.先等温膨胀,再等压压缩,其体积必小于起始体积
C.先等容升温,再等压压缩,其温度有可能等于起始温度
D.先等容加热,再绝热压缩,其内能必大于起始内能
26. (14分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(14分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为: 。
(2)已知六水合氯化铁在水中的溶解度如下:
|
温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度(g/100gH2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3・6H2O的方法是: 。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(4)吸收剂X是: ;吸收塔中吸收剂X的作用是: 。
(5)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol·L-1Na2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。则样品中氯化铁的质量分数为: 。
(6)用FeCl3溶液(32%-35%)腐蚀印刷线路板的废液中含FeCl3、FeCl2和CuCl2。
①若用电化学方法使废液再生。
阳极反应为:2Fe2+ – 2e- = 2Fe3+
阴极反应为:
②若用化学方法,回收废液中铜的方法是(用反应式表示并简述操作要点):
|
|
 27.(14分)油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝食品的添加剂,逐步转换为无铝添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)、碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
27.(14分)油条是一种深受群众喜爱的传统食品,在百姓早餐桌上一直占有重要位置。但油条中铝含量超标问题十分普遍,是影响群众健康的食品安全隐患。从2009年5月下旬开始,浙江省的油条加工停用含铝食品的添加剂,逐步转换为无铝添加剂配方和工艺,从而保证百姓吃上安全、放心的油条。油条无铝配方由碳酸氢钠(小苏打)、碳酸氢铵(臭粉)组成。为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验。
|
|||
 |
|||
|
|
|
①按图组装仪器,检查装置的气密性;
②将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;
③关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;
④称得装置B的质量为m4g、装置C的质量为m5g。
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1) 装置A中发生反应的化学方程式为
(2) 装置B的作用为
装置C的作用为
(3)实验过程中通入N2的目的为
(4)用下列各项所提供的数据能计算出w(NaHCO3)的是( ) (填选项字母)
|

(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3) (填“能”或“不能”)。若能,则w(NaHCO3)的计算式为: ,若不能,此问不作答。
|
|
|
|

已知:①当苯环上连有甲基时,再引入的其它基团主要进入它的邻位或对位;当苯环上连有羧基时,再引入的其它基团主要进入它的间位。
②苯胺( )分子中的氨基易被氧化。
)分子中的氨基易被氧化。
请回答下列问题:
(1)反应①的反应类型为 ,反应①除了主要生成A物质外,还可能
生成 等副产物(写出一种副产物的结构简式即可)
(2)途经I中的步骤③的目的是
(3)已知化合物B的分子式为C7H5NO4,请写出B的结构简式: 。
(4)途径II中的步骤①和⑤能否互换,判断并说明理由: 。
(5)与途径II相比,途经I的缺点是步骤多,产率低。有同学受途径II的启发,自行设计了途径III,请写出反应⑧的化学方程式:
。
(6)苯佐卡因有多种同分异构体。其中有两个对位取代基,-NH2直接连在苯环上,分子结构中含有酯基的同分异构体有:
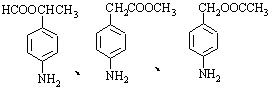
、 。
宁波市2010年高三模拟考试卷
25.(16分)下表为部分短周期元素化合价及相应氢化物沸点的数据:
|
元素性质 |
元素编号 |
|||||||
|
A |
B |
C |
D |
E |
F |
G |
H |
|
|
氢化物的沸点(℃) |
-60.7 |
-33.4 |
-111.5 |
100 |
-87.7 |
19.54 |
-84.9 |
-161.5 |
|
最高化合价 |
+6 |
+5 |
+4 |
|
+5 |
|
+7 |
+4 |
|
最低化合价 |
-2 |
-3 |
-4 |
-2 |
-3 |
-1 |
-1 |
-4 |
已知:
①A与D可形成化合物AD2、AD3,可用于制备强酸甲; ②B与D可形成化合物BD、BD2,可用于制备强酸乙。 请回答: (1)表中属于第三周期元素的是 (用表中元素编号填写)。
(2)写出H的最高价氧化物的电子式:
比较A、D、G三种简单阴离子的半径大小:r( )>r( )>r( ) (均用实际的元素符号表示)
(3)由表中D元素和氢元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________________。 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(4)分子组成为ADG2的物质在水中会强烈水解,产生使品红溶液褪色的无色气体和一种强酸。该反应的化学方程式是: 。
(5)工业生产强酸乙时可用纯碱溶液处理尾气,该反应如下: BD+BD2+Na2CO3=2 +CO2 ①横线上某盐的化学式应为 ②每产生44.8L(标准状况)CO2,被吸收尾气的质量是 g。
(6)请设计一个实验方案,使得铜和稀的强酸甲反应,得到蓝色溶液和氢气,在答题卡指定位置绘出实验装置图,作出必要的说明即可。
13.下列溶液中各微粒的浓度关系或说法正确的是
A.0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、
④NH3·H2O;c(NH4+) 由大到小的顺序是:①>②>③>④
C.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D.0.1mol·L-1的醋酸的pH=a,0.01mol·L-1的醋酸的pH=b,则a+1=b
第II卷
12. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2 2NH3 △H<0。反应过程中H2、N2和NH3物质的量变化如右图所示,据图判断下列叙述不正确的是
2NH3 △H<0。反应过程中H2、N2和NH3物质的量变化如右图所示,据图判断下列叙述不正确的是
A.反应开始到第一次平衡时,N2的平均反应速率为0.0625 mol·(L·min)-1 ,H2的转化率为75%
B.反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[ c3(H2) ·c(N2)]=(0.15 mol·L-1) 2/[ (0.075 mol·L-1) 3 ·(0.125 mol·L-1)]
C.从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂。
D.从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动。
11.原子数相同、电子总数相同的粒子,互称为等电子体。硼元素可形成三个等电子体阴离子:BO2-、BC25-和BN2n-,则BN2n-中的n值为
A.1 B.2 C.3 D.4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com