
19.配制100 mL 1 mol·L-1氢氧化钠溶液,下列操作错误的是( )
A.在托盘天平上放两片大小、质量一样的纸,然后将氢氧化钠放在纸片上进行称量
B.把称得的氢氧化钠放入盛有适量蒸馏水的烧杯中,溶解、冷却,再把溶液移入容量瓶中
C.用蒸馏水洗涤烧杯、玻璃棒2-3次,洗涤液也移入容量瓶中
D.沿着玻璃棒往容量瓶中加入蒸馏水, 到离刻度线1-2cm时改用胶头滴管滴加,直到溶液凹面恰好与刻度相切
到离刻度线1-2cm时改用胶头滴管滴加,直到溶液凹面恰好与刻度相切
18.同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳气体。下列对两容器中气体的说法正确的是( )
A.所含分子数和质量均不相同 B.含有相同数目的分子和电子
C.含有相同数目的中子、原子和分子 D.含有相同数目的质子和中子
17.1L 1mol/L NaOH溶液吸收0.8moL CO2 所得溶液中的物质的量浓度之比为( )
A.1∶3 B.2∶1 C.2∶3 D.3∶2
16.下表中评价合理的是( )
|
选项 |
化学反应及其离子方程式 |
评价 |
|
A |
Fe3O4与稀硝酸反应: 2 Fe3O4 +18 H+=6 Fe3+ + H2↑+8 H2O |
正确 |
|
B |
向碳酸镁中滴加稀盐酸: CO32-+2H+=CO2↑+H2O |
错误,碳酸镁不应写成离子形式 |
|
C |
向硫酸铵溶液中加入氢氧化钡溶液: SO42-+ Ba2+== BaSO4↓ |
正确 |
|
D |
FeBr2溶液与等物质的量的Cl2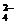 反应: 反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl- + B   r2 r2 |
错误,Fe2+与Br-的化学计量数之比为1:2 |
15.下列是某兴趣小组根据课本实验设计的一个能说明Na2CO3与NaHCO3热稳定性的套管实验。请观察下图的实验装置、分析实验原理,下列说法错误的是( )
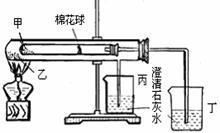 A.甲为小苏打,乙为纯碱
A.甲为小苏打,乙为纯碱
B.要证明NaHCO3受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C.整个实验过程中可以看到丙烧杯的澄清石灰水没变浑浊
D.同质量的甲和乙完全反应消耗的同浓度的盐酸体积:甲>乙
14.向含有Na+、Mg2+、Fe2+和Al3+的溶液中加入足量Na2O2微热并搅拌后,再加入过量稀盐酸,溶液中大量减少的离子是( )
A.Na+ B.Fe2+ C.Mg2+ D.Al3
13.用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA
B.1 mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C.1 mol H2O2在MnO2作催化剂的条件下完全分解生成O2,转移电子数为2NA
D.1 mol Na2O2中含有的阴离子数目为2NA
12.一定能在下列溶液中大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.c(H+)=1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
11.由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是( )
A.②④⑤③① B.③②④①⑤
C.③④②⑤① D.②④③⑤①
10.将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→“出汗”→变成白色固体(粉末),下列有关叙述不正确的是( )
A.表面迅速变暗是因为钠与空气中的氧气反应生成了氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的水蒸气在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程的所有化学反应均为氧化还原反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com