
37.(8分)[物理--物理3-4]
(1)一足够大的水池内盛有某种透明液体,液体的深度为H,在水池的底部放一点光源S,其中一条光线以30°入射角射到液体与空气的界面上,它的反射光线与折射光线的夹角为105°,如图所示。求:
①液体的折射率;
②液体表现亮斑的面积。
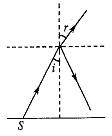
(2)光是一种电磁波,当光从水中射入空气中时,波长会 (填写“变长”、“变短”、“不变”),如果光的频率为6.7×104Hz,空气中光速约为3.0×103m/s,则在空气中的波长为 m。
36.(8分)[物理--物理3-3]
(1)一种油的密度为 ,摩尔质量为M。取体积为V的油慢慢滴出,可滴n滴。将其中一滴滴在广阔水面上形成面积为S的单分子油膜,求阿伏加伽德罗常数。
,摩尔质量为M。取体积为V的油慢慢滴出,可滴n滴。将其中一滴滴在广阔水面上形成面积为S的单分子油膜,求阿伏加伽德罗常数。
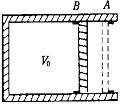
(2)如图所示,水平放置的气缸内壁光滑,活塞厚度不计,在A、B两处设有限制装置,使活塞只能在A、B之间运动,B左边气缸的容积为V0,A、B之间的容积为0.1V0。开始时活塞在B处,缸内气体的压强为0.9p0(p0为大气压强),温度为297K,现缓慢加热缸内气体,当气体的温度升高到多高时,活塞恰好到达A处?
35.(8分)[生物--现代生物科技专题]
人的血清白蛋白(HAS)在临床上需求量很大,通常从血中提取。但由于艾滋病病毒等人类感染性病原体造成的威胁与日俱增,使人们对血液制品顾虑重重。如果应用现代生物科学技术,将人的血清白蛋白基因专入奶牛细胞中,那么利用牛的乳汁生产血清白蛋白就会安全、高效地满足人类需求。下图是利用牛奶乳汁生产人类血清白蛋白的图解,根据下图回答:
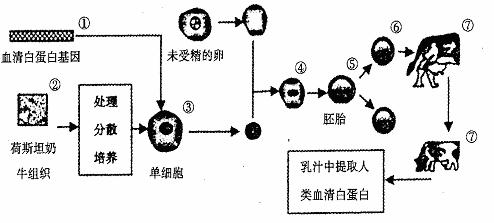
(1) 以上过程中涉及到的现代生物技术,属于细胞水平的有:____________。
(2)
(2)在基因工程中,我们称①为目的基因,请你举出获取目的基因的主要方法:
_________。在①进入③之前要构件基因表达载体,这是基因工程的核心,除目的基因外,基因表达载体还必须含有___________,实现①进入③的常用方法是___________。
(3)图中②一般经过__________处理可以得到③,从③到④的过程中一般利用未受精的卵母细胞去核后作为受体细胞,对卵母细胞的去核处理一般选择在_________时期进行。
(4)把⑤送入⑦的最佳时期是__________。
34.(8分)[生物--生物技术实践]
有些微生物能合成纤维素酶,通过对这些微生物的研究,使人们能够利用秸秆等废弃物生产酒精,用纤维素酶处理服装面料等。研究人员用化合物A、硝酸盐、磷酸盐以及微量元素配制的培养基,成功地筛选到能产生纤维素酶的微生物。分析回答问题。
(1)培养基中加入的化合物A是 ,为微生物的生长提供 ,这种培养基属于 培养基。
(2)为了筛选出能产生纤维素酶的微生物,向培养基中加入 。
(3)在筛选出能产生纤维素酶的微生物之前,可用液体培养基培养,增加微生物的浓度。若获得纯净的菌株,常采用平板划线的方法进行接种,此过程所用的接种工具是 ,操作时采用 灭菌的方法;还可用 方法操作。
(4)实验结束后,使用过的培养基应该进行灭菌处理才能倒掉,这样做的目的是 。
33.(8分)[化学--有机化学基础]
分子式为C12H14O2的有机物F广泛用于香精的调香剂。为了合成该物质,某实验室的科技人员设计了下列合成路线:
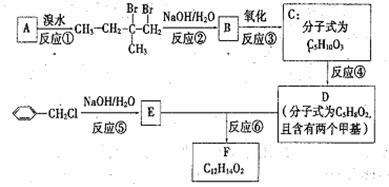
试回答下列问题:
(1)A物质在核磁共振氢谱中能呈现 种峰;
(2)C物质的官能团名称 ;
(3)上述合成路线中属于消去反应的是 (填编号);
(4)写出反应⑥的化学方程式: ;
(5)写出E的属于芳香族化合物的任意2种同分异构体(不含E)的结构简式:
。
32.(8分)[化学--物质结构与性质]
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为 < < (填元素符号)。
(2)E元素基态原子的电子排布式为 。
(3)XZ2分子中含有 个π键。
 (4)Z氢化物的沸点比Q氢化物的沸点高,理由是
。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是
。
(5)X元素可形成X60单质,它与金属钾掺杂在
一起制造了一种富勒烯化合物,其晶胞如图
所示(白球位于立方体的体心和顶点,小黑
球位于立方体的面上),该化合物中X60与钾
原子个数比为 。
31.(8分)[化学--化学与技术]
镁作为目前密度最小的金属材料之一,广泛应用于航空航天工业、军工领域、交通领域。以下为镁的两种冶炼方法。
I.目前宁夏已经探明的镁矿储量居全国第一,青龙山白云岩(CaCO3·MgCO2)是皮江法冶炼镁的优质原料,该方法将白云石煅烧为氧化物(CaO·MgO),然后在还原炉中经1200℃高温真空条件下用硅还原MgO生成粗镁,粗镁再经过精炼、铸锭得到成品镁,工艺流程如图所示。
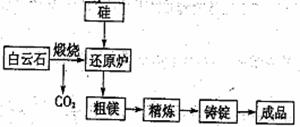
(1)写出还原炉内用硅还原MgO生成粗镁的化学反应方程式: 。
(2)在还原过程中反应温度越高镁的产率越高,说明该反应的反应热
△H 0(填“大于”或“小于”)
II.海水综合利用可以制备金属镁,其流程如下图所示:

(3)海水中的镁以Mg2+的形式存在,流程中将Mg2+转化为Mg(OH)2,然后又重新转化为Mg2+的目的是 。
(4)将MgCl2·6H2O在一定条件下加热得到无水MgCl2,“一定条件”指的是 。
(5)综合比较两种方法,皮江法的缺点是 。
30.(14分)为探究Cl2、SO2同时通入H2O中发生的反应,某化学兴趣小组设计了如下图所示的实验装置。
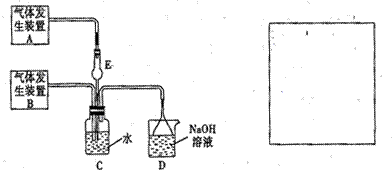
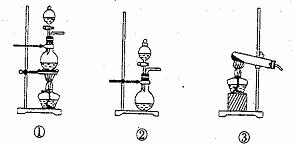
(1)化学兴趣小组的同学为制取Cl2、SO2气体,现采用Na2SO3粉末与70%的浓硫酸为原料制取SO2,采用MnO2和浓盐酸为原料制取C12。已知SO2的溶解度比Cl2大40倍,在此实验中,E仪器的作用是__________;发生装置B应选择以下三种装置中的___________(填序号)。
(2)资料显示等物质的量的Cl2、SO2同时通入H2O中恰好反应生成两种酸,请写反应的化学方程式 。
(3)为不影响产物的检验,小组成员认为上述整套装置有一处不合理,应在 装置之间(填代号)连接一装置,请在装置图右图的方框中画出简单装置图,并注明装置中盛有的试剂。
(4)已知干燥的二氧化硫和氯气在活炭催化剂存在下反应生成液SO2Cl2,反应为
SO2(g)+Cl2(g) SO2Cl2(l)△H=-97.3kJ/mol,SO2Cl2溶于水后得到的产物与上述实验结果相同。
SO2Cl2(l)△H=-97.3kJ/mol,SO2Cl2溶于水后得到的产物与上述实验结果相同。
①为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
②已知20℃时,AgCl的溶液解度为0.00015g,Ag2SO4的溶解度为0.796g,则SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液时,最先产生的沉淀是 。
[选做部分]
共8个题,考生从中选择2个物理题、1个化学题和1个生物题在答题卡规定的区域作答。
29.(14分)能源问题当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向。
 I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g) CO2(g)+H2(g)
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g) CO2(g)+H2(g)
△H<0。在850℃时,平衡常数K=1。
(1)若降低温度到750℃时,达到平衡时K 1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3molH2O、1.0molCO2和x molH2,则:
①当x=5.0时,上述反应向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a b(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ·mol液态水转化为气体水吸收44kJ的热量。
(3)请写出乙醇燃烧生成气态水的热化学方程式 。
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL3mol/LnaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3) c(HCO-3)(填“大于”、“小于”或“等于”,)原因是 (用文字叙述)。
28.(14分)原子序数由小到大排列的四种短周期元素X、Y、Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)W元素在元素周期表中的位置 。
(2)均由X、Y、Z三种元素组成的三种常见物质A、B、C分别属于酸、碱、盐,其中含有离子键的物质为 (填化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)有人设想寻求合适的催化剂和电极材料,以X2、Y2为电极反应物,以HCl-NH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池总反应式 (用化学式表示,不要求配平),放电时H+移向 极(填“正”或“负”)
(5)由X、Y、Z、W和一种常见金属元素组成相对分子质量为392的化合物D,1molD中含有6mol结晶水。对化合物A进行如下实验:
a. 取含有0.1molD的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和4.48L(标准状况)无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;b.另以含有0.1molD的溶液,加入过量BaCl2溶液产生46.6g白色沉淀,加盐酸沉淀不溶解。
①D的化学式为 。
②在25℃下,测定浓度均为a mol/L的化合物B和D的混合溶液pH=7,且含金属离子的浓度为b mol/L,则溶液中除H+、金属离子外的阳离子浓度为 mol/L。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com