
14、 某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的改变如图所示。据图分析,下列判断错误的是
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的改变如图所示。据图分析,下列判断错误的是
A.
Ksp[Fe( OH)3]< Ksp[Cu(OH)2]
OH)3]< Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由 点变到
点变到 点
点
C. 、d两点代表的溶液中c(H+)与c(OH-)乘积相等
、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D. 、
、 两点Fe(OH)3、Cu
两点Fe(OH)3、Cu (OH)2所在溶液分别达到饱和
(OH)2所在溶液分别达到饱和
非选择题
15(10分)、一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:

相关信息如下:
①(NH4)2SO4在水中可溶,在乙醇中难溶
②[Cu(NH3)4]SO 4·H2O在乙醇·水混合溶剂中的溶解度随乙醇体积分数的变化曲线如上示意图。[
4·H2O在乙醇·水混合溶剂中的溶解度随乙醇体积分数的变化曲线如上示意图。[
请根据以上信息回答下列问题:
(1)写出从悬浊液B到溶液C步骤中固体溶解的方程式 。
(2)试剂D为 ,操作1为
(3)下列选项中,最适合作为洗涤的洗涤液是 。
A. 乙醇 B. 蒸馏水 C. 乙醇和水的混合液 D. 饱和硫酸钠溶液
(4)干燥不宜 采用加热干燥的方法,可能的原因是 。
采用加热干燥的方法,可能的原因是 。
16(9分)、已知:①25℃时弱电解质电离平衡数:Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13;难溶电解质的溶度积常数:KSP(CaF2)=1.5×10-10
②25℃时,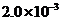 mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下旬问题: 图2
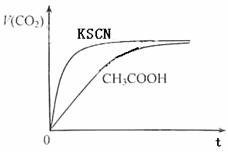
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是
反应结束后所得两溶液中,c(CH3COO-) c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka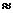 。
。
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体
mol·L-1 CaCl2溶液等体 积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过计算判断 (填“是”或”否”)有沉淀产生。(在以下空白处写出计算过程)
积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),通过计算判断 (填“是”或”否”)有沉淀产生。(在以下空白处写出计算过程)
17(8分)、在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
 (2)常温下在20mL0.1mol/L
Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的
(2)常温下在20mL0.1mol/L
Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的 各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如右图所示。
各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如右图所示。 回答下列问题:[
回答下列问题:[
①在同一溶液中,H2CO3、HCO3-、 CO32-(填:“能”或“不能”) 大量共存。
②当pH=7时,溶液中的电荷守恒关系是: 。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=[ c(HCO3-)×c(OH-)]/c(CO32-)=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
13、 有关分散系的下列说法正确的是
有关分散系的下列说法正确的是
A.浊液的分散质可用过滤的方 法从分散剂中分离出来
法从分散剂中分离出来
B.任何物质在水中溶解时都有一定的溶解度
C.同一种溶质的饱和溶液要比不饱和溶液的浓度大一些
D.分散质粒子大小为1nm到100nm的分散系是胶体
12、下列有关物质的量 浓度溶液配制的叙述正确的是
浓度溶液配制的叙述正确的是
A.浓硫 酸稀释时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
酸稀释时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.定容时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.称量氢氧化钠固体时,应在托盘上放上一张称量纸以防止氢氧化钠腐蚀托盘
D.配制480mL0.1mol/LNa2SO4溶液,应称取7.1g Na2SO4
11、下列推断正确的是
A.SO2 是酸性氧化物,能与NaOH溶液反应
B.Na2O、Na2O2组成元素相同,均与 CO2发生化合反应
C.CO、NO、 NO2都是不成盐氧化物且都是大气污染物
D.酸性氧化物一定能与水反应生成酸
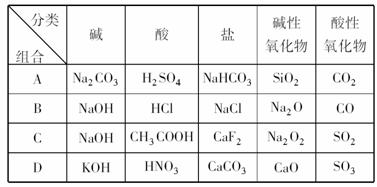
10、下列关于物质分类的正确组合是:
9、常温下,下列各组离子在指定溶液中不能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、Cl-、Na+
B.由水电离的c(H+)=1×10-3mol/L的溶液中:Al3+、K+、Cl-、SO42-
C.c(H+)/ c(OH-)=1012的溶液中:NH4+、Cu2+、NO3-、Cl-
D.c(Fe3+)=0.1mol/L的 溶液中:K+、OH-、SiO32-、SCN-
溶液中:K+、OH-、SiO32-、SCN-
8、下列叙述正确的是[
A.将pH=a的醋酸稀溶液稀释1倍后溶液的pH=b,则a> b
B.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7
C.1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0
D.若1mLpH=1的盐酸与100mLNaOH溶液混合后,溶液的pH=7则NaOH溶液的11
不定项选择题(本题包括7小题,每小题4分,共计28分。每小题有一个或两个选 项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分)
项符合题意。若正确答案只包括一个选项,多选时,该题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分)
7、下列有关实验操作中正确的是
A.将试纸放入溶液中观察其颜色变化,跟标准比色卡比较测溶液的pH;
B.向取出的5%的硫酸铜溶液中加入过量浓氨水制取氢氧化铜沉淀
C.向取出的氯化亚铁溶液中加入KSCN溶液检测是否氯化亚铁溶液变质;
D.用铝粉和镁条分别和同浓度的稀盐酸反应,通过观测剧烈程度比较铝和镁的单质活动性强弱
6、设NA为阿伏加德罗常数的数值,下列说法正确的是
A.16gCH4中含有4NA个C-H键
B.1mol·L-1NaCl溶液含有NA个Na+
C.1mol Cu和足量稀硝酸反应产生 NA个NO分子
D.常温常压下,22.4L CO2中含有 NA个CO2分子
5、在一定温度下,在100mL某一元弱酸HA的溶液中,含有该弱酸的分子数为5.42×1020个,并测得该溶液的c(H+)=10-3mol/L。在该平衡体系中,这种一元弱酸的电离度约为: A.9%; B.10%; C.3%; D.0.1%;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com