
21.(14分)某芳香族化合物A的结构简式是 (其中R为饱和烃基),A在一定条件下有如下图所示的转化关系。已知E的蒸气密度是相同条件下H2密度的74倍,分子组成符合CaHbO2。



 (1)E的分子式是
。
(1)E的分子式是
。
 (2)关于上述各步转化中,下列说法正确的是
。
(2)关于上述各步转化中,下列说法正确的是
。
 a.
以上各步没有涉及加成反应 b. E比C的相对分子质量小18
a.
以上各步没有涉及加成反应 b. E比C的相对分子质量小18
 c. A、B、C、D中都含有-COOH d . A与C发生酯化反应后得到的有机物分子式可能是C18H18O4Cl
c. A、B、C、D中都含有-COOH d . A与C发生酯化反应后得到的有机物分子式可能是C18H18O4Cl
 (3)写出所有符合下列要求的E的同分异构体的结构简式: 、 (①分子中苯环上有三个取代基,且苯环上的一氯代物有两种 ②1 mol该有机物与足量银氨溶液反应能产生4 mol Ag)。
(3)写出所有符合下列要求的E的同分异构体的结构简式: 、 (①分子中苯环上有三个取代基,且苯环上的一氯代物有两种 ②1 mol该有机物与足量银氨溶液反应能产生4 mol Ag)。
 (4)针对以下不同情况分别回答:
(4)针对以下不同情况分别回答:
 ①若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F;D能发生银镜反应。
①若E能使溴的四氯化碳溶液褪色,还能与NaHCO3溶液反应生成F;D能发生银镜反应。
 则D的结构简式是 。欲由A通过一步反应得到F,该反应的化学方程式是 。
则D的结构简式是 。欲由A通过一步反应得到F,该反应的化学方程式是 。
 ②若E中除苯环外,还含有一个六元环,则C→E的化学方程式是 。
②若E中除苯环外,还含有一个六元环,则C→E的化学方程式是 。
20.(10分)X、Y、Z为不同短周期非金属元素的气态单质。在一定条件下能发生如下反应: (g),
(g), 。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
。甲、乙可化合生成离子化合物,甲的相对分子质量小于乙。
 (1)X的结构式是 。
(1)X的结构式是 。
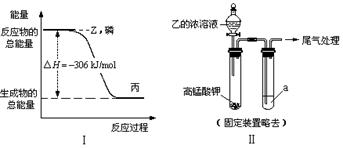
 (2)磷在Z气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是8电子结构,丙的电子式是 。磷单质和Z单质反应生成1 mol丙时,反应过程与能量变化如图Ⅰ所示,该反应的热化学方程式是 。
(2)磷在Z气体中燃烧可生成液态丙分子,也可生成固态丁分子。已知丙分子中各原子最外层均是8电子结构,丙的电子式是 。磷单质和Z单质反应生成1 mol丙时,反应过程与能量变化如图Ⅰ所示,该反应的热化学方程式是 。
 (3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则a是
的水溶液。若仅将a换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是 。
(3)某同学拟用图Ⅱ所示装置证明氧化性Z>I2,已知高锰酸钾与乙的浓溶液反应生成Z,则a是
的水溶液。若仅将a换为甲的浓溶液,实验时会产生大量白烟并有气体单质生成,该反应的化学方程式是 。

 (4)向一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时加入由甲和乙中的一种或几种元素组成的某纯净物,即可生成白色沉淀,
(4)向一定浓度的BaCl2溶液中通入SO2气体,未见沉淀生成,若在通入SO2气体的同时加入由甲和乙中的一种或几种元素组成的某纯净物,即可生成白色沉淀, 该纯净物可能是________、________。
该纯净物可能是________、________。
19.(8分)废旧印刷电路板的回收利用可实现资源再生,并减少污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末。
(1)下列处理印刷电路板的回收利用可实现资源再生,并减污染。废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末是 。
A.热裂解形成燃油 B.露天焚烧 C.作为有机复合建筑材料的原料 D.直接填埋
(2)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(S)+2H+(aq)=== Cu2+(aq)+H2(g) ΔH=64.39kJ·mol-1
2H2O2(I)===2H2O(I)+O2(g) ΔH=-196.46kJ·mol-1
H2(g)+
 O2(g)===H2O(I) ΔH=-285.84kJ·mol-1
O2(g)===H2O(I) ΔH=-285.84kJ·mol-1
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(3)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0 mol·L-1H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
|
温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
|
铜平均溶解速率 (×10-3mol·L-1·min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 。
(4)在提纯后CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀。制备CuCl的离子方程式是 。
18.(8分)以氯化钾和钛白厂的副产品硫酸业铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

(1) 反应I前需在FeSO4溶液中加入__________(填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑 C.KI溶液 D.H2
(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为 。
17.(10分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:
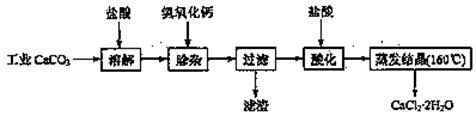
(1)除杂操作是加入Ca(OH)2,调节溶液pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是 。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③ 。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有_____ _____。
②计算上述样品中CaCl2·2H2O的质量分数为_____ _____。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有 ;_____ _____。
16.实验室将9g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所 得固体中含金属单质为18g,则该氧化物粉末可能是
得固体中含金属单质为18g,则该氧化物粉末可能是
 A.
A.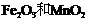 B.
B. 和
和 C.
C. 和
和 D
D  和FeO
和FeO
15.如右图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵
溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
 A.生铁块中的碳是原电池的正极
A.生铁块中的碳是原电池的正极
 B.红墨水柱两边的液面变为左低右高
B.红墨水柱两边的液面变为左低右高
 C.两试管中相同的电极反应式是:
C.两试管中相同的电极反应式是:
 D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
14.有4中混合溶液,分别由等体积0.1mol/L的2种溶液混合面成:①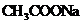 与
与 ;
;
②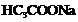 与
与 ③
③ 与
与 ④
④ 与
与 ;则下列正确的是
;则下列正确的是
A.pH:②>③>④>①
B. :②>④>③>①
:②>④>③>①
 C.溶液中:①>③>②>④
D.
C.溶液中:①>③>②>④
D. :①>④>③>②
:①>④>③>②
13. 2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他在表面化学领域研究所取得的开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如下图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指
2007年诺贝尔化学奖授予德国化学家Gerhard Ertl,以表彰他在表面化学领域研究所取得的开拓性成就。某反应在Pt/Al2O3/Ba催化剂表面吸附与解吸作用的机理如下图所示(图中HC表示碳氢化合物,nitrate指硝酸盐),该机理研究是指
A.汽车尾气催化转化处理 B.钢铁生锈机理
C.合成氨工业催化氧化机理 D.氢氧燃烧电池电极反应机理
12.警察常从案发现场的人体气味来获取有用线索,人体气味的成分中含有以下化合物:①辛酸;②壬酸;③环十二醇;④5,9一十一烷酸内酯;⑤十八烷⑥己醛;⑦庚醛。下列说法正确的是
 A.①、②、⑥分子中碳原子数小于10,③、④、⑤分子中碳原子数大于10
A.①、②、⑥分子中碳原子数小于10,③、④、⑤分子中碳原子数大于10
 B.①、②是无机物,③、⑤、⑦是有机物
B.①、②是无机物,③、⑤、⑦是有机物
 C.①、②是酸性化合物,③、⑤不是酸性化合物
C.①、②是酸性化合物,③、⑤不是酸性化合物
 D.②、③、④含氧元素,⑤、⑥、⑦不含氧元素
D.②、③、④含氧元素,⑤、⑥、⑦不含氧元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com