
18.我国未来将建立月球基地,并在绕月轨道上建造空
 间站。如图所示,关闭发动机的航天飞机在月球引力作用下沿椭圆轨道向月球靠近,并将在椭圆的近月点B处与空间站对接。已各空间站绕月轨道为r,周期为T,万有引力常量为G,月球的半径为R. 那么以下选项正确的是 ( )
间站。如图所示,关闭发动机的航天飞机在月球引力作用下沿椭圆轨道向月球靠近,并将在椭圆的近月点B处与空间站对接。已各空间站绕月轨道为r,周期为T,万有引力常量为G,月球的半径为R. 那么以下选项正确的是 ( )
(1)航天飞机到达B处由椭圆轨道进入空间站轨道时必须减速
(2)图中的航天飞机正在加速地飞向B处
(3)月球的质量为
(4)月球的第一宇宙速度为
A.(1)(2)(4) B.(1)(3)(4)
C.(1)(2)(3) D.(2)(3)(4)
17.在空气阻力大小恒定的条件下,小球从空中下落,与水平地面相碰后弹到空中某一高度。
 以向下为正方向,其速度随日寸、问变化的关系如图所示,取g=10m/s2,则以下结论正确的是 ( )
以向下为正方向,其速度随日寸、问变化的关系如图所示,取g=10m/s2,则以下结论正确的是 ( )
A.小球能弹起的最大高度为1m
B.小球能弹起的最大高度为0.45 m
C.小球弹起到最大高度的时刻如t2=0.80s
D.空气阻力与重力的比值为1:5
15.直流电源的电动势为E、内电阻为r,用它给直流电动机供电使之工作。电动机的线网电阻是R,电动机两端的电压为U,通过电动机的电流为I,导线电阻不计,若经过时间t,则 ( )
A.电流在整个电路中做的功等于I2(R+r)i
B.电动机输出的机械能等于[E-I(R+r)]It
C.电动机输出的机械能等于UIt
D.电流在整个电路中做的功等于(E-Ir)it
 16.如图所示,在电容器C的两端接有一个圆环形导体回路,在圆环回路所围的面积之内存在着垂直纸面向里的匀强磁场B,已知圆环帕半径r=5cm,电容器的电容C=20μF,当磁场B以2×10-2T/s的变化率均匀增加时,则电容器的 ( )
16.如图所示,在电容器C的两端接有一个圆环形导体回路,在圆环回路所围的面积之内存在着垂直纸面向里的匀强磁场B,已知圆环帕半径r=5cm,电容器的电容C=20μF,当磁场B以2×10-2T/s的变化率均匀增加时,则电容器的 ( )
A.a板带正电,电荷量为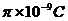
B.a板带负电,电荷量为
C.a板带正电,电荷量为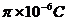
D.a板带负电,电荷量为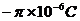
13.物理学的发展改变了人类对物质世界的认识,推动了科学技术的创新和革命,促进了物质生产的繁荣与人类文明的进步。下列表述正确的是 ( )
A.牛顿认为光是一种粒子流
B.库仑首次用电场线形象地描述了电场
C.麦克斯韦从实验上证明了电磁波的存在
D.查德威克通过实验证实了电子的存在
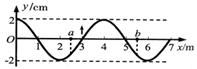 14.一列周期为T的简谐横波沿x轴的某一方向传播,已知t=0时刻的波形如图所示,此时平衡位置位于x=3m处的质点正在向上运动。若a、b两质点平衡位置的坐标分别为xa=2.5m,xb=5.5m,则 ( )
14.一列周期为T的简谐横波沿x轴的某一方向传播,已知t=0时刻的波形如图所示,此时平衡位置位于x=3m处的质点正在向上运动。若a、b两质点平衡位置的坐标分别为xa=2.5m,xb=5.5m,则 ( )
A.当a质点处在波峰时,b质点恰在波谷
B.t=T/4时,a质点正在向y轴负方向运动
C.t=3T/4时,b质点正在向y轴负方向运动
D.任何时刻a、b两质点的速度都不可能相同
12.某化学小组欲探究①溴乙烷在不同溶剂中与NaOH发生不同类型的反应;②某CuO和Cu混合粉末中CuO的质量分数。下列实验设计方案及预期结论合理的是 ( )
|
|
探究 |
方案 |
结论 |
|
A |
① |
取2mL溴乙烷,加入适量NaOH水溶液,加热。一段时间后,向溶液中滴加AgNO3溶液,有淡黄色沉淀产生 |
溴乙烷中的溴变成了Br-,溴乙烷与NaOH水溶液发生取代反应 |
|
B |
① |
取2mL溴乙烷,加入适量NaOH乙醇溶液,加热,将产生的气体通入KMnO4酸性溶液中,溶液褪色 |
反应生成乙烯,溴乙烷与NaOH乙醇溶液发生消去反应 |
|
C |
② |
称取质量为m1的混合物,在空气中加强热至质量不再变化,冷却、称量,所得固体质量为m2 |
CuO的质量分数为: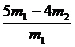 |
|
D |
② |
称取质量为m1的混合物,放入足量稀硝酸中溶解,过滤、洗涤、干燥、称量,残留固体质量为m2 |
CuO的质量分数为: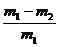 |
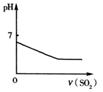
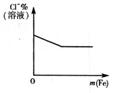
11.下列反应中,相关示意图像错误的是 ( )
|
A |
B |
C |
D |
|
将二氧化硫通入到一定量氯水中 |
将氨水滴入到一定量氯化铝溶液中 |
将铜粉加入到一定量浓硝酸中 |
将铁粉加入到一定量氯化铁溶液中 |
|

10.CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜 片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量的酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是 ( )
①铜片做阴极,石墨做阳极 ②铜片做阳极,石墨做阴极
③阳极有氧气生成 ④阴极有氢气生成
⑤白色沉淀在阳极附近生成 ⑥白色沉淀在阴极附近生成
⑦阳极区溶液变蓝的原因是2Cu+4I――4e-=2CuI↓+I2 碘遇淀粉变蓝
⑧阳极区溶液变蓝的原因是4OH――4e―=2H2O+O2↑O2将I-氧化为I2,碘遇淀粉变蓝
A.只有②④⑤⑦ B.只有①④⑥⑦ C.只有②③⑤⑧ D.只有①③⑥⑧
9.下列叙述错误的是 ( )
A.把aL0.1mo1/L的CH3COOH溶液与b L 0.1 mol/L的KOH溶液混合,所得溶液中一定存在:c(K+)+c(H+)=c(CH3COO-)+c(OH-)
B.把0.1mol/L的NaHCO3,溶液与0.3 mol/L的Ba(OH)3溶液等体积混合,所得溶液中一定存在:c(OH-)>c(Ba+)>c(Na+)>c(H+)
C.向1mol/L的CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高
D.常温下,在pH=3的CH3COOH溶液和pH=11的NaOH溶液中,水的电离程度相同
8. 某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3
(g) △H<0。
某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g) 2NH3
(g) △H<0。
下列分析正确的是 ( )
A.平衡后加入N2,该反应的△H增大
B.若平衡昏升高温度,则平衡常数K变大
C.平衡后再充入NH3,达到新平衡时,NH3的百分含量变大
D.若反应前充人的N2与H2物质的量相等,达平衡时N2的转化率比H2的高
7.下列叙述中正确的是 ( )
A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B.向Fel2溶液中通入少量Cl2,再滴加少量CCl4,振汤、静置,下层液体为紫色
C.向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D.将SO2气体通入溴水,欲检验是否有SO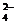 生成,可向溶液中滴加Ba(NO3)2溶液
生成,可向溶液中滴加Ba(NO3)2溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com