
1.下列电子式中错误的是
A.Na+
B. C.
C. D.
D.
6.用电子式表示化合物的形成过程。如HCl的形成过程:

|

[例](2008山东卷)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)冶炼铜的反应为: ;若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
;若CuFeS2中Fe的化合价为+2,反应中被还原的元素是___________(填元素符号)。
(2)上述冶炼过程产生大量SO2。下列处理方案中合理的是________(填代号)。
a.高空排放 b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
(3)过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2 :

通过改变反应途径Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。____ _、
______ _____(不必配平)
(4)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、AI2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
, 据以上信息回答下列问题:
a.除去Al3+的离子方程式是_________ _____。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为_____________。
证明炉渣中含有FeO的实验现象为______ _____。
[解析](1)由氧化还原反应概念易知,反应中Cu、O的化合价降低,被还原。(2)从能够吸收SO2和变废为宝的角度出发可用b、c来回收。(3)Fe3+有氧化性,可氧化I-,而改变反应途径;Fe2+有还原性,可被K2S2O8氧化而改变反应途径。(4)Al(OH)3能溶于NaOH溶液,而Fe(OH)3不溶,可加入过量的NaOH溶液除去Al(OH)3 ;利用Fe2+的还原性,能使酸性KMnO4溶液褪色,可用稀硫酸、KMnO4溶液来验证炉渣中含有FeO。
[答案](1)Cu、O (2)b、c
(3)2Fe3++2I- 2Fe2++I2 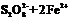

(4)a.Al3+ + 4OH- == AlO2- + 2H2O
b.稀硫酸、KMnO4溶液 ;稀硫酸浸取炉渣所得溶液使KMnO4溶液褪色
化学用语单元测试题
5.电极反应式:表示电极上发生氧化反应或还原反应的式子。要能正确书写原电池的正、负极反应式,总反应式;电解池的阴、阳极反应式,总反应式。详见第36讲。
4.热化学方程式:表明反应放出或吸收热量的化学方程式。书写热化学方程式应注意:
(1)需标明反应物、生成物的聚集状态。
(2)反应系数只表示物质的量,不再表示分子个数,所以可以用分数或倍数。
(3)⊿H表示反应热的数值,无需注明+或-号,但要有单位,且要与反应系数成比例。
(4)需注明测定的温度和压强,若不注明则指的是温度为25℃,压强为101kPa
3.电离方程式:表示电解质在溶液中或熔化状态下发生电离的过程的方程式。要能正确理解强、弱电解质的概念;准确区分强、弱电解质;清楚强、弱电解质的电离方式是不一样的,有完全电离和部分电离之分,有一步电离和多步电离之分,书写时要注意可逆符号。详见第32讲。
2.离子方程式:用实际参加反应的离子的符号来表示离子反应的式子。 要熟练掌握离子方程式的书写规则,书写时要清楚反应物的量对离子方程式的影响。所写出的离子方程式必须要符合客观事实,等式两边要遵守质量守恒和电荷守恒定律,如是氧化还原反应还要遵守电子转移守恒原理……详见第4讲。
1.化学方程式:用化学式来表示化学反应的式子。化学方程式的书写必须要尊重事实,要配平(即要遵守质量守恒定律),还要注明反应发生的条件,有气体生成须注“↑”,溶液中有沉淀生成则须注“↓”。
2.离子的电子式:
①阳离子:简单的阳离子(一般指单原子形成的阳离子)是元素原子失去最外层电子后形成的,此时若原最外层没有电子,其电子式就是它的离子符号,如钠离子写成Na+、钡离子写成Ba2+;复杂的阳离子是原子团失去一个或几个电子形成的,其电子式不仅要画出各原子的最外层电子以及它们的成键关系,而且要用“[ ]”将原子团括起来,并在其右上角标明所带的正电荷数,电子式中的小黑点和小叉总数为原子团中各原子最外层电子总数减去原子团所带的电荷数值。如:
|
|
复杂的阴离子,其电子式要根据各原子的成键关系画出所有原子的最外层电子,然后用“[ ]”将它们括起来,并在右上角标明所带的负电荷数,其小黑点和小叉总数为原子团中
各原子的最外层电子数之和加上所带的电荷数值的绝对值. 如:SO42-写成
[  ]2-
]2-
|
|
|
|
|
所有原子的最外层电子。如H2写成H:H ;Cl2写成︰Cl︰Cl︰ 4.化合物的电子式: ①共价化合物是原子间通过共价键形成的化合物,原子间的单键即为一对共用电子,若
为双键则有两对共用电子,依此类推。一般来说,8减去原子的最外层电子数等于该原
子的成键数目(H例外)。写电子式时,共用电子对写在两成键原子之间,未成键的最
外层电子,也应在元素符号周围画出。在共价化合物中,各元素原子最外层一般都达到
了8电子(或2电子)的稳定结构。 如:HCl写成 H︰Cl︰,CO2写成 O ∷C∷ O ;
至于含氧酸的电子式,一般来说先由酸的元数确定其结构中所含-OH的数目(一元酸有
一个-OH,n元酸有n个-OH),然后再根据含氧酸的分子组成来确定其结构式或电子式。
如:HClO写成H︰O︰ Cl︰ ②离子化合物由阴、阳离子的电子式组成,但相同的离子不能合并,若有多个阳离子或
多个阴离子,书写时要使每一个离子都与带相反电荷的离子直接相邻,并注意对称、规
范。如:NaCl写成Na+[︰Cl︰]-;MgCl2写成[︰Cl︰]-Mg2+ [︰Cl︰]-;
|
|
|
|
|
|
|
|
点和小叉总数为各原子的最外层电子数之和。如:-OH写成·O︰H
|
|
|
|
|
|
离子化合物:如CaCl2的形成,︰Cl·+ ·Ca· +·Cl︰→[︰Cl︰]-Ca2+[︰Cl︰]-
|

第3课时 表示物质变化的化学用语
1.原子的电子式:
|
7.化合价:一种元素一定数目的原子,跟其他元素一定数目的原子化合的性质。
|

[例](2010上海卷,2)下列有关物质结构的表述正确的是
 A.次氯酸的电子式
A.次氯酸的电子式
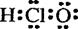 B.二氧化硅的分子式 SiO2
B.二氧化硅的分子式 SiO2
C.硫原子的最外层电子排布式3s23p4
D.钠离子的结构示意图
答案:C
解析:此题考查了物质结构中的原子的核外电子排布、原子结构的表示、化学键、物质的构成等知识点。次氯酸的电子式为: ,A错;二氧化硅是原子晶体,其结构中不存在分子,B错;S是16号元素,其核外电子排布为:1s22s22p63s23p4,C对;钠离子是钠原子失去了最外层的1个电子,其原子结构示意图为:
,A错;二氧化硅是原子晶体,其结构中不存在分子,B错;S是16号元素,其核外电子排布为:1s22s22p63s23p4,C对;钠离子是钠原子失去了最外层的1个电子,其原子结构示意图为: ,D错。
,D错。
技巧点拨:在分析电子排布式的对错时,可以首先写出相应的电子排布式一一对照,得出答案;也可以依次验证电子数目的正误、填充顺序的正误、填充电子数的正误进行判断。
[方法技巧]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com