
5. 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
⑴实验测得,1 g甲醇在氧气中充分燃烧生成二氧化碳和液态水释放出22.7 kJ的热量,试写出甲醇燃烧的热化学方程式。
⑵已知反应CH3-CH3→CH2=CH2+H2,有关化学键的键能如下。
化学键 C-H C=C C-C H-H
键能(kJ·mol-1) 414.4 615.3 347.4 435.3
试计算该反应的反应热。
⑶依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行理论推算。试依据下列热化学方程式,计算反应2C(s)+2H2(g)+O2(g) CH3COOH(l)的焓变
CH3COOH(l)的焓变
①CH3COOH(l)+2O2(g) 2CO2(g)+2H2O(l) DH1 = -870.3 kJ·mol-1
2CO2(g)+2H2O(l) DH1 = -870.3 kJ·mol-1
②C(s)+O2(g) CO2(g) DH2 = -393.5 kJ·mol-1
CO2(g) DH2 = -393.5 kJ·mol-1
③H2(g)+1/2O2(g) H2O(l) DH3 = -285.8 kJ·mol-1
H2O(l) DH3 = -285.8 kJ·mol-1
3. 已知①NH3(g)+HCl(g) NH4Cl(s) DH 1
= -176 kJ·mol-1
NH4Cl(s) DH 1
= -176 kJ·mol-1
②NH3(g) NH3(aq)
DH 2
= -35.1 kJ·mol-1
NH3(aq)
DH 2
= -35.1 kJ·mol-1
③HCl(g) HCl(aq)
DH 3 = -72.3 kJ·mol-1
HCl(aq)
DH 3 = -72.3 kJ·mol-1
④NH3(aq)+HCl(aq) NH4Cl(aq) DH 4 = -52.3 kJ·mol-1
NH4Cl(aq) DH 4 = -52.3 kJ·mol-1
⑤NH4Cl(s) NH4Cl(aq) DH 5
NH4Cl(aq) DH 5
则第⑤个反应方程式中的DH5为(单位为 kJ·mol-1)
A.+16.3 B.-16.3 C.+335.7 D.-335.7
4. 按要求书写热化学方程式(是离子反应的也可用离子方程式表示)。
⑴表示强酸和强碱中和反应的热化学方程式:_________________________________。
⑵火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供。反应过程中生成的气体可参与大气循环。测得当反应过程中有1mol水蒸气生成时放出161kJ的热量。试写出反应过程中的热化学方程式:___________________________。
⑶工业生产硫酸过程中,SO2在接触室中被催化氧化为SO3,已知该反应为一放热反应。现将2mol SO2、1mol O2充入一密闭容器充分反应后,放出热量98.3 kJ,此时测得SO2的转化率为50%,其热化学方程式可表示为____________________________。
⑷已知A、B两种气体在一定条件下可发生反应:2A+B==C+3D+4E。现将相对分子质量为M的A气体mg和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成。在相同温度下测得反应前后压强分别为6.06×105Pa和1.01×106Pa,又测得反应共放出QkJ热量。试根据上述实验数据写出该反应的热化学方程式______________。
4.中和热测定的实验步骤
 ⑴组装量热器:保温隔热效果一定要好。小烧杯口要与大烧杯口相平,以减少热量损失。烧杯间要填加隔热材料,提高保温隔热效果。
⑴组装量热器:保温隔热效果一定要好。小烧杯口要与大烧杯口相平,以减少热量损失。烧杯间要填加隔热材料,提高保温隔热效果。
⑵量取一定量盐酸倒入小烧杯中,测定并记录盐酸温度。
①温度计上的酸要用蒸馏水冲洗干净,且冲洗液要转移到小烧杯中
②盐酸浓度宜小不宜大
⑶量取定量氢氧化钠溶液,测定并记录氢氧化钠溶液温度
①碱液要稍过量,以确保盐酸被完全中和。
②碱液浓度宜小不宜大。
⑷将氢氧化钠溶液倒入小烧杯中,搅拌,充分反应后,测定并记录混合液的最高温度
①氢氧化钠溶液要一次性快速倒入小烧杯中,且不能洒在外面。
②要用环形玻璃棒轻轻搅动溶液,使酸碱充分反应。
③实验操作时动作要快,尽量减少热量散失。重复实验两次 。
⑸计算
[思想方法]
[例1]化学反应中通常伴随着能量变化,下列说法中错误的是
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
[分析]本题主要考查能量的转化与利用煤是重要的能源,燃烧时放出大量的热能,但这不是煤中的全部化学能,因为其主要燃烧产物CO2中仍有化学能,A项正确。电解物质时,是将电能转化为化学能,而不是化学能转化为电能,B项错误。TNT(三硝基甲苯)爆炸时,部分化学能转化成了动能,C项正确。镁条燃烧时放出大量热,产生耀眼的白光,故镁条的部分化学能转化成了光能,D项正确。本题应选B。
[例2]下列化学用语的相关表述中,其中正确的有
A.因H+(aq)+OH-(aq) H2O(l) DH
H2O(l) DH -a kJ·mol-1,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ
-a kJ·mol-1,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ
B.因CuSO4·5H2O(s) CuSO4(s)+5H2O(l) DH
CuSO4(s)+5H2O(l) DH +bkJ·mol-1,故1 mol CuSO4(s)溶于水时,放出热量bkJ
+bkJ·mol-1,故1 mol CuSO4(s)溶于水时,放出热量bkJ
C.因氢气的燃烧热为ckJ·mol-1,故水电解的热化学方程式为:2H2O(l) 2H2(g)+O2(g) DH = +c kJ·mol-1
2H2(g)+O2(g) DH = +c kJ·mol-1
D.因N2(g)+3H2(g) 2NH3(g) DH = -d kJ·mol-1,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
2NH3(g) DH = -d kJ·mol-1,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ
[分析]本题主要考查能量变化中的重要概念。由于NaOH固体溶于水会放出大量的热,因此A错。选项B给出的热化学方程式是胆矾的分解,而要求的CuSO4(s)溶于水的热效应,两者无联系,B错。燃烧热的定义是1 mol燃料燃烧所放出的热量,由知可知水电解正确的热化学方程式为2H2O(l) = 2H2(g)+O2(g) DH = +2c kJ·mol-1,C错。本题应选D
[例3]甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g) 2CO(g)+4H2(g) DH = -71 kJ·mol-1
2CO(g)+4H2(g) DH = -71 kJ·mol-1
②CO(g)+2H2(g) CH3OH(l)
DH = -90.5 kJ·mol-1
CH3OH(l)
DH = -90.5 kJ·mol-1
③CH4(g)+2O2(g) CO2(g)+2H2O(l) DH=-890 kJ·mol-1
CO2(g)+2H2O(l) DH=-890 kJ·mol-1
下列结论错误的是
A.CO(g)+2H2(g) CH3OH(g) DH>-90.5 kJ·mol-1
CH3OH(g) DH>-90.5 kJ·mol-1
B.甲醇的燃烧热为764 kJ·mol-1
C.若CO的燃烧热为282.5 kJ·mol-,则H2的燃烧热为286 kJ·mol-1
D.反应②在任何温度下均能自发进行
[分析]本题主要考查盖斯定律的应用。由于CH3OH(g)转化为CH3OH(l)要放出热量,结合题给反应②可知选项A正确(要注意DH为负值),(③×2-①)/2得:CO(g)+2H2(g)+3O2(g) CO2(g)+2H2O(l) DH=-854.5 kJ·mol-1……④,④-②得甲醇的燃烧热为DH = -764 kJ·mol-1,B正确,由热化学方程式④得CO的燃烧热+2×H2的燃烧热
CO2(g)+2H2O(l) DH=-854.5 kJ·mol-1……④,④-②得甲醇的燃烧热为DH = -764 kJ·mol-1,B正确,由热化学方程式④得CO的燃烧热+2×H2的燃烧热 854.5 kJ·mol-1,由此可得H2的燃烧热为286 kJ·mol-1,C正确。反应②是放热熵减的反应,即DH<0,△S<0,因此可判断反应②在低温下能自发进行,选项D错。本题应选D。
854.5 kJ·mol-1,由此可得H2的燃烧热为286 kJ·mol-1,C正确。反应②是放热熵减的反应,即DH<0,△S<0,因此可判断反应②在低温下能自发进行,选项D错。本题应选D。
[例4]下列说法中正确的是
A.中和热的测定实验中需要用的主要玻璃仪器有:二只大小相同的烧杯、二只大小相同的量筒、温度计、环形玻璃搅拌捧
B.可以用保温杯代替烧杯做有关中和热测定的实验
C.在测定中和热的实验中,至少需要测定并记录的温度是3次
D.测定中和热实验中,若所使用的稀NaOH溶液的物质的量稍大于稀盐酸,则会导致所测得的中和热数值偏高
[分析]本题主要考查中和热测定的原理和实验基本操作。选项A错误,为了防止散热,在中和热测定的实验中应选用一大一小两只烧杯,小烧杯和大烧杯之间应用塑料泡沫隔开。很显然,从防止散热的效果看,使用保温杯完全可以,而且防止散热效果更好,选项B正确。对于选项C作如下分析:中和热测定的原理是:首先根据公式Q cmΔt求出反应过程中放出的热量,然后再根据ΔH
cmΔt求出反应过程中放出的热量,然后再根据ΔH -Q/n(H2O)计算中和热。式中Δt表示反应后的最高温度与反应前盐酸与氢氧化钠的平均温度之差,因此每次实验至少需要测定3次温度,由于中和热的测定属于定量实验,因此至少平行做二次实验才能求出其正确值,所以在整个实验过程中最少需要测定并记录温度的次数是6次,选项C错。对于选项D,在中和热测定过程中为了提高实验的正确度,须保证酸和碱完全反应,在实验中通常使一种物质稍过量一些,这是正确的操作方法,因此选项D错误。本题应选B。
-Q/n(H2O)计算中和热。式中Δt表示反应后的最高温度与反应前盐酸与氢氧化钠的平均温度之差,因此每次实验至少需要测定3次温度,由于中和热的测定属于定量实验,因此至少平行做二次实验才能求出其正确值,所以在整个实验过程中最少需要测定并记录温度的次数是6次,选项C错。对于选项D,在中和热测定过程中为了提高实验的正确度,须保证酸和碱完全反应,在实验中通常使一种物质稍过量一些,这是正确的操作方法,因此选项D错误。本题应选B。
[专题演练]
1. 下列图示关系不正确的是



2. 下列实验现象不能说明反应放热的是
A.钾放入水中浮于水面、熔成小球
B.向包有Na2O2粉末的棉花上滴几滴水,棉花着火
C.苯与液溴的混合物中加入少量铁粉(做催化剂),有大量溴蒸气产生
D.将混有酚酞的苏打溶液加热,红色变深
3.热反应方程式的计算类型
⑴根据热化学方程式进行计算
①一般计算的方法是:将DH看作热化学方程式中的一项,再按有关化学方程式的计算步骤、格式进行计算,得出有关数据。
②盖斯定律的应用:如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的。即:
若 ,则有:DH = DH1+DH2。
,则有:DH = DH1+DH2。
据此,也可推出以下应用方式:
[方式一]若有(a)A(g)+M(g) = B(g) DH1,(b)A(l)+M(g) = B(g) DH2
(c)A(g) = A(l) DH3,则(c) = (a)-(b),即DH3 = DH1-DH2。
[方式二]若有(a)A(s)+M(g) = B(s) DH1,(b)C(s)+M(g) = D(s) DH2
(c)A(s)+D(s) = B(s)+C(s) DH3
则(c) = (a)-(b),即DH3 = DH1-DH2
⑵反应热的大小比较
①同一反应中,生成物状态不同
如:A(g)+B(g) = C(g) DH1<0,A(g)+B(g) = C(l) DH2<0,
因为产物C(g)比C(l)所含内量多,反应放出热量少,所以DH1>DH2。(注意:放热越多,DH越小)
②同一反应中,反应物状态不同
如:S(g)+O2(g) = SO2(g) DH1<0,S(s)+O2(g) = SO2(g) DH2<0
因为反应物S(g)比S(s)所含内量多,所以反应放出热量就多,得DH1<DH2。
2.书写热反应方程式应注意的问题
⑴△H只能写在标有反应物和生成物状态的化学方程式的右边,并用“空格”隔开。若为放热反应△H为“-”;若为吸热反应△H为“+”。△H的单位一般为 kJ·mol-1。
⑵注意反应热△H与测定条件(温度、压强等)有关。因此书写热化学方程式时应注明△H的测定条件。绝大多数△H是在25℃、101325Pa下测定的,可不注明温度和压强。
⑶注意热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,并不表示物质的分子或原子数,因此化学计量数可以是整数,也可以是分数。
⑷注意反应物和产物的聚集状态不同,反应热数值以及符号都可能不同。因此,必须注明物质的聚集状态(s、l、g)才能完整地体现出热化学方程式的意义。热化学方程式中不用“↑”和“↓”。
⑸注意热化学方程式是表示反应已完成的数量。由于△H与反应完成物质的量有关,所以方程式中化学式前面的化学计量数必须与△H相对应,如果化学计量数加倍,则△H也要加倍。当反应逆向进行,其反应热与正反应的反应热数值相等,符号相反。例如:已知H2(g)+1/2O2(g)=H2O(1) △H=-285.8kJ·mol-1。则2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ·mol-1;H2O(1)=H2(g)+1/2O2(g) △H=+285.8 kJ·mol-1。
⑹△H的单位“kJ·mol-1”的含义。并不是指每摩尔具体物质反应时伴随的能量变化是多少千焦,而是指给定形式的具体反应以各物质的化学计量数来计量其物质的量时伴随的能量变化。如2H2(g) + O2(g) = 2H2O(g) △H =-483.6 kJ·mol-1中的反应热是指每摩尔反应[2H2(g) + O2(g) = 2H2O(g)],放出的热量为483.6kJ。因此△H与化学反应方程式的写法有关,例如:H2(g) + 1/2 O2(g) = H2O(g) △H =-241.8 kJ·mol-1。另外反应热还与反应物的状态有关:2H2(g) + O2(g) = 2H2O(l) △H =-571.6 kJ·mol-1。
⑺不论化学反应是否可逆,热化学方程式中的反应热△H表示反应进行到底(完全转化)时的能量变化。如:2SO2(g)+O2(g)=2SO3(g) △H=-197 kJ·mol-1,是指2mol SO2(g)和1mol O2(g)完全转化为2mol SO3(g)时放出的能量。若在相同的温度和压强时,向某容器中加入2mol SO2(g)和1mol O2(g)反应达到平衡时,放出的能量为Q,因反应不能完全转化生成2mol SO3(g),故Q<197kJ。
1.燃烧热和中和热
|
|
燃烧热 |
中和热 |
|
定义 要点 |
在1大气压时1 mol物质完全燃烧生成稳定的化合物时所放出的热量 |
在稀溶液中,酸碱发生中和反应生成1 mol水,所放出的热量 |
|
标准 |
1mol可燃物 |
1mol水 |
|
单位 |
kJ·mol-1 |
kJ·mol-1 |
|
热化学方程式的书写 |
以燃烧1 mol可燃物为标准配平其余物质的化学计量数(常用分数表示) |
以生成1 mol水为标准来配平其余物质的化学计量数(常用分数表示) |
|
备注 |
必须生成稳定的化合,如C燃烧应生成CO2而不是CO,H2燃烧应生成液态水而非气态水 |
①强酸和强碱在稀溶液中发生中和,中和热是DH(强)=-57.3 kJ·mol-1②弱酸代替强酸(或弱碱代替强碱),因电离吸热,反应热增大。 |
3.如果已知物体的受力情况,由牛顿第二定律求出加速度,再由运动学公式就可以知道物体的运动情况;相反地,已知物体的运动情况,知道了加速度,由牛顿第二定律就可以求出未知的力,这就是动力学的两类基本问题,加速度是个“桥梁”.



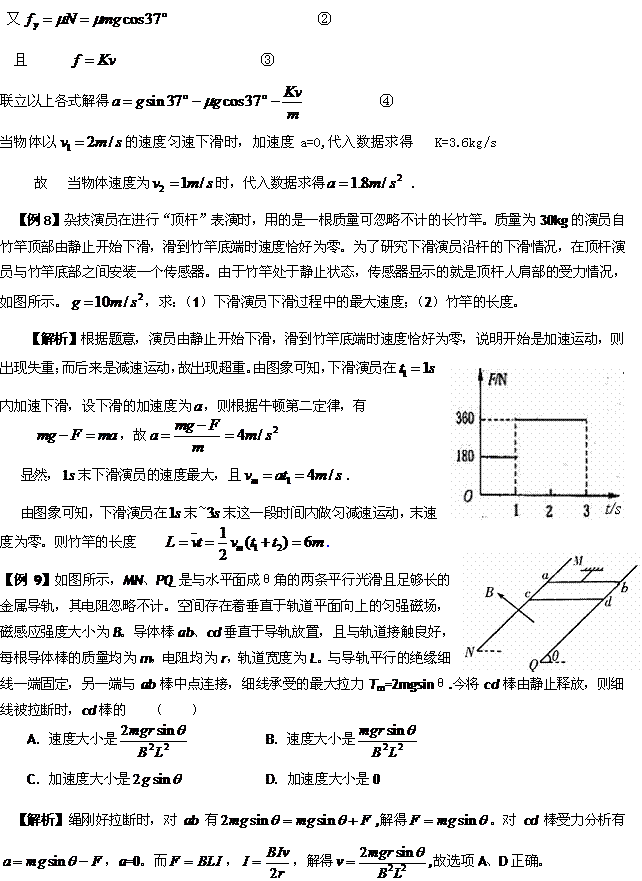

2.运用牛顿运动定律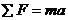 列方程的常用方法:①力的合成法:这种方法非常适用于物体只受到两个力的作用而产生加速度的情形,这里合外力的方向就是加速度的方向。②正交分解法:当物体受到两个以上的力的作用而产生加速度时,常常用正交分解法进行解答,可以根据物理问题的实际情景采用分解力或者分解加速度的方法进行.多数情况下是把力正交分解在加速度方向和垂直于加速度的方向两个分量,即:Fx=ma(沿着加速度方向);Fy=0(垂直于加速度的方向)。
列方程的常用方法:①力的合成法:这种方法非常适用于物体只受到两个力的作用而产生加速度的情形,这里合外力的方向就是加速度的方向。②正交分解法:当物体受到两个以上的力的作用而产生加速度时,常常用正交分解法进行解答,可以根据物理问题的实际情景采用分解力或者分解加速度的方法进行.多数情况下是把力正交分解在加速度方向和垂直于加速度的方向两个分量,即:Fx=ma(沿着加速度方向);Fy=0(垂直于加速度的方向)。
1.第二定律在第一定律的基础上,进一步研究了物体在受力作用条件下的运动状态,确定了力、质量以及加速度的瞬时对应关系,是牛顿三个运动定律的核心。牛顿第二定律具有四性,即①矢量性:物体在某一时刻加速度的大小和方向,是由该物体在这一时刻所受到的合外力的大小和方向来决定的;②瞬时性:加速度与力是同一时刻的对应量,即同时产生、同时变化、同时消失;③独立性;④同体性:即加速度和合外力、质量必须是对应于同一个物体的.
21.已知椭圆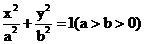 的右焦点为F,右准线与x轴交于E点,若椭圆的离心率e=
的右焦点为F,右准线与x轴交于E点,若椭圆的离心率e=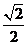 ,且
,且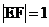
(1)求a,b的值;
(2)若过F的直线交椭圆于A,B两点,且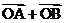 与向量
与向量 共线(其中O为坐标原点),求
共线(其中O为坐标原点),求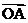 与
与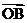 的夹角;
的夹角;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com