
17.(6分)联氨(N2H4)是一种无色可燃的弱碱性液体,是液体大推力火箭常用的高能燃料。
⑴已知联分子中的N原子最外层满足8电子相对稳定结构,则下列说法正确的是
A.联氨(N2H4)结构与C2H4相似,存在N=N双键
B.一分子联氨中含有的电子对数目为5
C.联氨中的N原子的杂化类型为sp3杂化
D.联氨能与HCl发生化合反应生成N2H6Cl2
⑵联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素和次氯酸钠、氢氧化钠溶液反应生成联氨、另外两种正盐和水,写出其反应的化学方程式 ;
⑶火箭推进器中分别装有联氨和过氧化氢,当它们混合时即产生气体,并放出大量热。 已知:12.8 g液态联氨与足量过氧化氢反应生成氮气和水蒸气,放出256.65 kJ的热量,写出该反应的热化学方程式 。
16.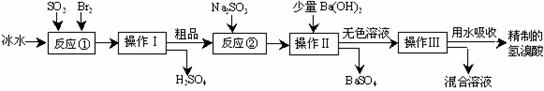 (12分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程:
(12分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制的流程:
根据上述流程回答下列问题:
⑴反应①中发生反应的化学方程式为 ;
⑵反应①中使用冰水的目的是 ;
⑶操作Ⅱ和操作Ⅲ的名称分别是 、 ;
⑷反应②中加入Na2SO3的目的是 ;
⑸上述流程中制得的氢溴酸往往带有淡淡的黄色。请设计简单实验加以探究(包含提出假设,然后进行验证的过程)。
。
15.(8分)有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Al3+、Fe2+、Ba2+、NO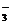 、SO
、SO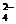 、Cl-、I-、HCO
、Cl-、I-、HCO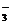 ,进行如下实验:
,进行如下实验:
|
实验步骤 |
实验现象 |
|
①取少量原溶液,加几滴甲基橙 |
溶液变红色 |
|
②取少量原溶液,浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,后在空气中又变成红棕色 |
|
③取少量原溶液,加BaCl2溶液 |
有白色沉淀生成 |
|
④取③中上层清液,加AgNO3溶液 |
有白色沉淀生成,且不溶于HNO3 |
|
⑤取少量原溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
⑴溶液中肯定存在的离子是________________________;
⑵溶液中肯定不存在的离子是________________________;
⑶为进一步确定其他离子,应该补充的实验是________ _ ________;
。
14.晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如右
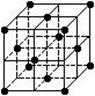 图所示(一个小黑点代表一个C60分子),下列说法正确的是
图所示(一个小黑点代表一个C60分子),下列说法正确的是
A.C60摩尔质量是720
B.C60与金刚石都是碳元素形成的单质分子
C.在C60晶胞中有14个C60分子
D.每个C60分子周围与它距离最近等距离的C60分子有12个
非选择题(共78分)
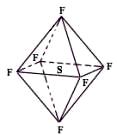
13.六氟化硫分子为正八面体构型(分子结构如图所示),难溶于水,在 高温下仍有良好的绝缘性,在电器工业方面具有广泛用途。下列推测正确的是
A.SF6中各原子均达到8电子稳定结构
B.SF6易燃烧生成SO2
C.SF6分子是含有极性键的非极性分子
D.SF6的一氯代物只有一种
12.下列说法正确的是
 A.含有阴离子的晶体中必含有阳离子
A.含有阴离子的晶体中必含有阳离子
B.由极性键构成的AB2型分子必是极性分子
C.非金属元素组成的化合物中只含有共价键
D.离子晶体中必含有离子健,分子晶体中必含有共价键
11.下列A~D四组,每组有两个反应,其中两个反应可用同一个离子方程式表示的是
|
|
(I) |
(II) |
|
A |
少量SO2通入Ba(OH)2溶液 |
过量SO2通入少量Ba(OH)2溶液 |
|
B |
少量浓氨水滴入Al2(SO4)3溶液 |
少量Al2(SO4)3溶液滴入浓氨水 |
|
C |
0.1mol Cl2通入含0.2mol FeBr2的溶液 |
0.3 molCl2通入1L 0.2 mol•L-1 FeBr2溶液中 |
|
D |
过量BaCl2溶液与少量Na2SO4溶液相混合 |
少量Ba(OH)2溶液与过量MgSO4溶液相混合 |
10.下列各选项所述的两个量,前者一定大于后者的是
①Al原子和N原子的未成对电子数;②Ag+、Cu2+与NH3形成配合物时的配位数;③NaCl的晶格能与MgO的晶格能;④F元素和O元素的电负性;⑤N和O元素的第一电离能;⑥H原子和H+离子的半径
A.①④⑤ B.②④⑥ C.④⑤⑥ D.③⑤⑥
8.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.25℃时,1.0 L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA
B.标准状况下,2.24 L Cl2与足量的水反应,转移的电子总数为0.2NA
C.室温下,40.0 g SiC 晶体中含有C-Si键的数目为4NA
D.标准状况下,22.4 L甲醇中含有的氧原子数为1.0 NA
|
B.Y元素气态氢化物的还原性最强
C.X元素的非金属性比Y元素非金属性强
D.Z和X可能以共价键结合形成一种无机非金属材料
7.下列叙述中,结论(事实)和对应的解释(事实)均不正确的是
A.金刚石的熔沸点高于晶体硅,因为C一C键能大于Si一Si键能
B.稀有气体的晶体属于原子晶体,因为其构成粒子间作用力为共价键
C.NH4+ 与Cu2+ 间不能形成配位键,因为NH4+ 中N 原子不存在孤对电子
D.p轨道之间只能形成π键,因为p轨道与p轨道之间只能以“肩并肩”方式重叠
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com